Dolutegravir
Dolutegravir ist ein virostatisch wirksamer Arzneistoff aus der Gruppe der Integrase-Strangtransfer-Inhibitoren (INSTI, Integrase-Inhibitoren), der im Rahmen einer Kombinationsbehandlung von HIV eingesetzt wird. Pharmazeutisch eingesetzt wird der Wirkstoff als Natriumsalz (Dolutegravir-Natrium).
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
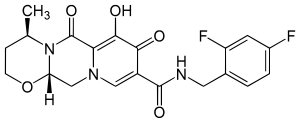 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Dolutegravir | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C20H19F2N3O5 | |||||||||||||||||||||
| Kurzbeschreibung |
orangefarbener Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 419,38 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Eigenschaften
Dolutegravir-Natrium ist ein weißes bis hellgelbes, nicht hygroskopisches Pulver. Es ist schwach löslich in Wasser und in wässrigen Medien sehr schwer löslich bei pH-Werten von 5,0 und 6,5 sowie praktisch unlöslich bei pH 1,2. Die Löslichkeit steigt bis zu einem Maximum zwischen pH 8 bis 10 an. Der Wirkstoff ist aufgrund seiner schlechten Löslichkeit und guten Permeabilität als BCS-Klasse-2-Verbindung eingestuft. Dolutegravir hat zwei chirale Zentren.[4]
Klinische Angaben
Anwendungsgebiete
Dolutegravir ist ein Inhibitor der viralen Integrase des humanen Immundefizienz-Virus (HIV 1) und findet Einsatz in der Behandlung von mit HIV 1 infizierten Patienten ab dem 12 Lebensjahr. Die Therapie erfolgt grundsätzlich nur in Kombination mit anderen HAART-Medikamenten (Hochaktive-antiretrovirale Kombinationstherapie). Dem älteren Integrase-Inhibitor Elvitegravir ist Dolutegravir auf Grund seiner pharmakologischen Eigenschaften (Bioverfügbarkeit, Eliminationshalbwertszeit) therapeutisch überlegen, da Elvitegravir mit einem sogenannten Booster wie z. B. Cobicistat oder Ritonavir kombiniert werden muss. Solche zusätzlich gegebenen Substanzen verlangsamen den Abbau von Elvitegravir durch Hemmung des Isoenzyms CYP3A4 aus der Cytochrom-P450-Familie, damit über einen längeren Zeitraum ausreichende Wirkstoffspiegel erreicht werden. Dolutegravir hingegen besitzt eine Plasmahalbwertszeit von 13–15 Stunden und kann daher ohne Booster als einmal tägliche Gabe verabreicht werden. Darüber hinaus bietet Dolutegravir unabhängig von einer gleichzeitigen Nahrungszufuhr eine gute Bioverfügbarkeit und kann daher unabhängig von Mahlzeiten verabreicht werden.
Unerwünschte Wirkungen
Als unerwünschte Nebenwirkungen können auftreten:[5][6]
- Sehr häufig: Kopfschmerzen, Durchfall und Übelkeit.
- Häufig: Hautausschlag, Juckreiz, Erbrechen, Magenschmerzen, Schlafstörungen, Schwindel, Abnormale Träume, Depression, Angstzustände, Erschöpfung, Blähungen, Anstieg der Leberenzyme und Anstieg von Kreatin-Phosphokinase.
- Gelegentlich: Hepatitis, Gelenkschmerzen, Muskelschmerzen. Außerdem Suizidversuch und Suizidgedanken (vor allem bei zuvor schon psychisch Erkrankten, z. B. an Depression)
- Selten: Leberversagen
außerdem
- Hypersensitive Reaktionen: 1 % oder weniger in klinischen Studien der Phase 3
- Beeinflussung der Serum-Leberwerte bei Patienten mit Hepatitis-B- oder C-Koinfektion: erhöhtes Risiko des Anstieges der Serum-Transaminase
- Umverteilung oder Akkumulation von Körperfett
- Immune Reconstitution Syndrome
Unerwünschte Wechselwirkungen können mit Reverse-Transkriptase-Inhibitoren wie Etravirin oder Efavirenz sowie mit Proteaseinhibitoren wie beispielsweise Forsamprenavir entstehen.[7][8][5]
Teratogenität
Bei Einnahme von Dolutegravir in den ersten Monaten der Schwangerschaft wurde ein leicht erhöhtes Risiko von Fehlbildungen beobachtet, insbesondere kommt es häufiger zu Neuralrohrdefekten, wie Spina bifida. In einer Beobachtungsstudie in Botswana mit fast 120.000 Geburten wurde ein Neuralrohrdefekt bei 0,08 % aller Kinder von nicht HIV-infizierten Müttern gefunden, bei 0,10 % aller Kinder von HIV-infizierten Müttern, deren antiretrovirale Therapie zum Zeitpunkt der Konzeption nicht Dolutegravir enthielt, und bei 0,30 % aller Kinder, deren HIV-infizierte Mütter zum Zeitpunkt der Konzeption Dolutegravir einnahmen, was eine Erhöhung um 0,20 Prozentpunkte ausmacht. Vermutet und in Zellkulturen gezeigt wurde ein Folsäure-Antagonismus.[9]
Pharmakologische Eigenschaften
Wirkungsmechanismus

Dolutegravir ist ein Integrase-Strang-Transfer-Inhibitor der zweiten Generation und stellt innerhalb dieser Wirkstoffklasse, dessen Erste-Generation-Vertreter Raltegravir und Elvitegravir sind, eine Weiterentwicklung dar. Die Manipulation der viralen Integrase (virales Protein), stellt einen Eingriff in Replikation des HI-Virus innerhalb der T-Zellen mit retroviraler DNA (reverse transkriptierter Virus-RNA nach DNA) dar. Sie ist als Nukleotidyltransferase für den Einbau viraler DNA-Stränge in das Chromosom der Zelle verantwortlich, und somit also neben der Protease und der Reverse-Transkriptase eines der drei Schlüsselmoleküle, das bei der Replikation von HI-Viren eine Rolle spielt. Als Endonuklease ist sie in der Lage, das menschliche Chromosom zu schneiden und die neu entstandene virale DNA einzufügen.
Dolutegravir ist außerdem weniger anfällig für Resistenzen durch Mutationen in Folge nicht vollständig inhibierter Virusreplikation. Die dissoziative Halbwertszeit ist länger als im Vergleich zu Elvitegravir und Raltegravir und gleicht somit Mutationen aus, die die antivirale Wirkung herabsetzen.[7]
Aufnahme und Verteilung im Körper
Der Arzneistoff besitzt eine Halbwertszeit von 13 bis 15 Stunden. Mehr als 30 Stunden bleibt die Plasmakonzentration über dem IC90-Wert. Das heißt, die Virusreplikation wird in diesem Zeitraum zu 90 % gehemmt. Die Wirksamkeit und Sicherheit wurde in vier Phase-III-Studien bewiesen mit einer Teilnehmerzahl von 2553 HIV-Patienten. Dolutegravir konnte, verglichen mit Raltegravir, die Viruslast vergleichbar effektiv senken, im Vergleich zu der Kombination Efavirenz/Emtricitabin/Tenofovir (Atripla) sogar signifikant effektiver.
Dolutegravir hemmt den Organo-Kation-Transporter 2, was zu einer erniedrigten tubulären Sekretion von Kreatinin und so zu einer Erhöhung des Serumkreatinin-Wertes führt, wobei dies jedoch nicht mit einer verringerten glomerulären Filtrationsrate oder eventuellen Nierenschäden in Verbindung gebracht werden konnte.
Der Abbau erfolgt über Uridindiphosphat-Glucuronosyltransferase 1A1 und Isoenzym CYP3A4 der Cytochrom-P450-Familie. Dabei werden CYP-Isoenzyme weder inhibiert noch induziert. Eisen und Calcium, wie sie in Nahrungsergänzungsmitteln bzw. Mineralienpräparaten enthalten sein können, vermögen die Resorption von Dolutegravir aus dem Darm nach oraler Gabe zu mindern. Arzneimittel, die Induktoren des Isoenzyms CYP3A4 sind, können die Plasmakonzentration von Dolutegravir herabsetzen und zu einem Therapieversagen durch Resistenzentwicklung führen. In diesem Fall ist eine Dosisanpassung von Dolutegravir zu erwägen. Zu den Induktoren von CYP34A gehören unter anderem Antazida, Rifampicin, Johanniskraut und bestimmte Antiepileptika. Hingegen können Inhibitoren wie z. B. Cobicistat oder Ritonavir zu erhöhten Plasmaspiegeln von Dolutegravir und in der Folge zu einem Auftreten von unerwünschten Wirkungen und/oder der Verstärkung von vorhandenen Nebenwirkungen führen.
Toxizität
In Tierexperimenten an Ratten und Affen konnte bei hoher Überdosierung (dem 24- bis 27-fachen der für den Menschen therapeutisch empfohlenen Tagesdosis) keine Toxizität festgestellt werden. In der Langzeitstudie (über 26 Wochen an Ratten und 38 Wochen an Affen) kam es zu gastrointestinalen Störungen, die vermutlichen auf die orale Applikation zurückzuführen sind.[10] Bei trächtigen Kaninchen wurde eine maternale Toxizität beobachtet (verminderte Futteraufnahme, reduzierte Gewichtszunahme, verminderte Harnausscheidung).
Dolutegravir hat sich in vitro an Bakterien und Säugerzellkulturen und in vivo im Micronukleustest an Nagetieren weder als mutagen noch klastogen gezeigt und darüber hinaus in Langzeittesta an Ratten auch nicht als karzinogen erwiesen.[10]
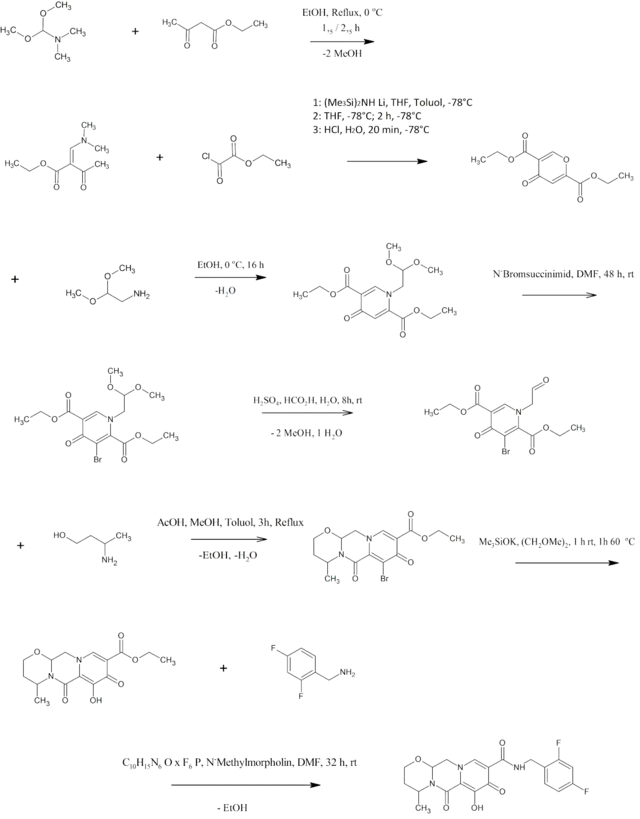
Synthese
Frühe Nutzenbewertung
In Deutschland müssen neu zugelassene Medikamente mit neuen Wirkstoffen seit 2011 gemäß § 35a SGB V einer „frühen Nutzenbewertung“ durch den Gemeinsamen Bundesausschuss (G-BA) unterzogen werden, wenn der pharmazeutische Hersteller einen höheren Verkaufspreis als nur den Festbetrag erzielen möchte. Nur wenn ein Zusatznutzen besteht, kann der Arzneimittelhersteller mit dem Spitzenverband der gesetzlichen Krankenkassen einen Preis aushandeln. Die Dossierbewertungen, auf deren Basis der G-BA seine Beschlüsse fasst, erstellt das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG).
In der ersten frühen Nutzenbewertung ging es 2014 um eine Behandlung therapienaiver und antiviral vorbehandelter Erwachsener und Jugendlicher ab 12 Jahren mit Dolutegravir in Kombination mit anderen antiretroviralen Arzneimitteln. Bei den vorbehandelten Erwachsenen wurde zusätzlich danach differenziert, ob eine Behandlung mit einem Integrase-Inhibitor die erste oder eine nachrangige Therapieoption darstellt.[11] Gemäß G-BA-Beschluss gibt es für therapienaive Erwachsene einen Beleg für einen beträchtlichen Zusatznutzen und für vorbehandelte Erwachsene, bei denen eine Behandlung mit einem Integrase-Inhibitor die erste Therapieoption darstellt, einen Hinweis auf einen geringen Zusatznutzen. Für die übrigen drei Patientengruppen ist ein Zusatznutzen gegenüber der jeweiligen zweckmäßigen Vergleichstherapie nicht belegt.[12]
2015 wurde für die Wirkstoffkombination Dolutegravir/Abacavir/Lamivudin dieselbe Einteilung in fünf Patientengruppen vorgenommen.[13] Gemäß G-BA-Beschluss gibt es für therapienaive Erwachsene einen Hinweis auf einen beträchtlichen Zusatznutzen gegenüber Efavirenz in Kombination mit Tenofovirdisoproxil plus Emtricitabin. Für die vier anderen Patientengruppen ist ein Zusatznutzen nicht belegt.[14]
2017 wurde die Evidenz für HIV-infizierte Kinder von 6 bis unter 12 Jahren betrachtet.[15][16] Gemäß G-BA-Besachluss ist ein Zusatznutzen weder für vorbehandelte noch für nicht vorbehandelte Kinder belegt.[17]
Nach ihrer Zulassung wurde 2018 die Kombination Dolutegravir/Rilpivirin zur Behandlung HIV-1-infizierter Erwachsener bewertet, die virologisch supprimiert und seit mindestens sechs Monaten auf einem stabilen antiretroviralen Regime eingestellt sind, kein virologisches Versagen in der Vergangenheit und keine bekannten oder vermuteten Resistenzen gegen Nicht-Nukleosidale Reverse-Transkriptase-Inhibitoren oder Integrase-Inhibitoren aufweisen.[18] Laut G-BA-Beschluss ist für diese Patienten ein Zusatznutzen gegenüber einer individuellen antiretroviralen Therapie in Abhängigkeit von den Vortherapien und ggf. unter Berücksichtigung von Nebenwirkungen nicht belegt.[19]
Nachdem 2019 die Kombination Dolutegravir/Lamivudin zur Behandlung HIV-1-infizierter Erwachsener und Jugendlicher (ab 12 Jahren, Körpergewicht mindestens 40 kg) zugelassen worden war, die keine bekannten oder vermuteten Resistenzen gegenüber der Klasse der Integrase-Inhibitoren oder Lamivudin aufweisen, wurde in einer weiteren frühen Nutzenbewertung erneut zwischen Erwachsenen und Jugendlichen sowie zwischen therapienaiven und antiratroviral vorbehandelten Patienten unterschieden.[20][21][22] Gemäß G-BA-Beschluss ist ein Zusatznutzen dieser Wirkstoffkombination gegenüber der jeweiligen zweckmäßigen Vergleichstherapie für keine der vier Gruppen belegt.[23]
Handelsnamen
Folgende Arzneimittel sind zugelassen:[24]
Monopräparate
- Tivicay (EU, CH, UK, USA)
Kombinationspräparate
- mit Lamivudin: Dovato (EU, CH, UK, USA)
- mit Lamivudin und Abacavir: Triumeq (EU, CH, UK, USA)
- mit Rilpivirin: Juluca (EU, CH, UK, USA)
Das erste Dolutegravir-Präprat war Tivicay, das 2013 in den USA und 2014 in der EU 2014 zugelassen wurde. Zulassungsinhaber ist die Firma ViiV Healthcare.
Weblinks
- Patent WO2006116764: Polycyclic carbamoylpyridone derivative having HIV integrase inhibitory activity. Angemeldet am 28. April 2006, veröffentlicht am 2. November 2006, Anmelder: Brian Alvin Johns, Takashi Kawasuji, Teruhiko Taishi, Yoshiyuki Taoda, Erfinder: SmithKline Beecham Corporation; Shionogi & Co., Ltd..
Einzelnachweise
- Patent EP2602260: Verfahren zur Herstellung einer Verbindung mit HIV-Integrase-hemmender Wirkung. Angemeldet am 4. August 2011, veröffentlicht am 28. September 2016, Anmelder: Shionogi & Co., Ltd., Erfinder: Yukihito Sumino, Kazuya Okamoto, Moriyasu Masui, Daisuke Yamada, Fumiya Ikarashi.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- EPAR Triumeq, abgerufen am 6. August 2021.
- Assessment report - Dovato vom 26. April 2029. Europäische Arzneimittelagentur.
- Highlights of Prescribing Information Tivicay. (PDF; 332 kB) FDA, August 2014; abgerufen am 4. Juni 2017.
- Gebrauchsinformation Information für Patienten. GlaxoSmithKline, November 2018; abgerufen am 10. April 2019.
- M. L. Cottrell, T. Hadzic, A. D. Kashuba: Clinical pharmacokinetic, pharmacodynamic and drug-interaction profile of the integrase inhibitor dolutegravir. In: Clinical Pharmacokinetics. Band 52, Nummer 11, November 2013, S. 981–994, doi:10.1007/s40262-013-0093-2, PMID 23824675, PMC 3805712 (freier Volltext) (Review).
- P. K. Quashie, R. D. Sloan, M. A. Wainberg: Novel therapeutic strategies targeting HIV integrase. In: BMC Medicine, Band 10, April 2012, S. 34, doi:10.1186/1741-7015-10-34, PMID 22498430, PMC 3348091 (freier Volltext) (Review).
- Rebecca Zash, Lewis Holmes, Modiegi Diseko, Denise L. Jacobson, Sean Brummel, Gloria Mayondi, Arielle Isaacson, Sonya Davey, Judith Mabuta, Mompati Mmalane, Tendani Gaolathe, M. Essex, Shahin Lockman, Joseph Makhema, Roger L. Shapiro: Neural-Tube Defects and Antiretroviral Treatment Regimens in Botswana. In: New England Journal of Medicine, 2019, Band 381, Ausgabe 9, 29. August 2019, S. 827–840, doi:10.1056/NEJMoa1905230
- Fachinformation Dolutegravir (Tivicay®). (PDF) GlaxoSmithKline Pharmaceuticals S.A., abgerufen am 25. September 2017.
- A14-08 Dolutegravir – Nutzenbewertung gemäß § 35a SGB V (Dossierbewertung). iqwig.de; abgerufen am 6. April 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Dolutegravir (HIV-Infektion, ≥ 12 Jahre). g-ba.de; abgerufen am 6. April 2020.
- A14-34 Dolutegravir/Abacavir/Lamivudin – Nutzenbewertung gemäß § 35a SGB V (Dossierbewertung). iqwig.de; abgerufen am 6. April 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Dolutegravir/Abacavir/Lamivudin (HIV-Infektion, ≥ 12 Jahre). g-ba.de; abgerufen am 6. April 2020.
- A17-1 Dolutegravir (HIV-Infektion) – Nutzenbewertung gemäß § 35a SGB V. (Memento des vom 6. April 2020 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. iqwig.de; abgerufen am 6. April 2020.
- A17-37 Dolutegravir (HIV-Infektion) – Addendum zum Auftrag A17-11. (Memento des vom 6. April 2020 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. iqwig.de; abgerufen am 6. April 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Dolutegravir (neues Anwendungsgebiet: HIV-Infektion, 6 bis < 12 Jahre). g-ba.de; abgerufen am 6. April 2020.
- A18-34 Dolutegravir/Rilpivirin (HIV-Infektion) – Nutzenbewertung gemäß § 35a SGB V. iqwig.de; abgerufen am 6. April 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Dolutegravir/Rilpivirin (HIV-Infektion). g-ba.de; abgerufen am 6. April 2020.
- A19-55 Dolutegravir/Lamivudin (HIV-Infektion) – Nutzenbewertung gemäß § 35a SGB V. iqwig.de; abgerufen am 6. April 2020.
- A19-102 Dolutegravir/Lamivudin (HIV-Infektion) – Addendum zum Auftrag A19-55. iqwig.de; abgerufen am 6. April 2020.
- A19-103 Dolutegravir/Lamivudin (HIV-Infektion) – 2. Addendum zum Auftrag A19-55. iqwig.de; abgerufen am 6. April 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Dolutegravir/Lamivudin (HIV-Infektion, ≥ 12 Jahre). g-ba.de; abgerufen am 6. April 2020.
- Arzneimittel mit Dolutegravir auf der Website der Europäischen Arzneimittelagentur (EMA). Arzneimittel mit Dolutegravir in der DailyMed-Datenbank der National Library of Medicine (NIH). AIPS-Datenbank der Swissmedic.
Abgerufen am 3. Januar 2023.