Diphenylzinndichlorid
Diphenylzinndichlorid ist eine chemische Verbindung aus der Gruppe der zinnorganischen Verbindungen.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
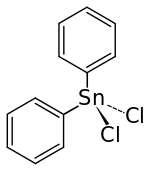 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Diphenylzinndichlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C12H10Cl2Sn | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 343,82 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
333–337 °C[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte
Über die erste Darstellung von Diphenylzinndichlorid wurde bereits 1878 von B. Aronheim berichtet. Dazu wurde Zinntetrachlorid mit Diphenylquecksilber über 12 Stunden in der Siedehitze in Ligroin umgesetzt:[2]
Gewinnung und Darstellung
Diphenylzinndichlorid kann technisch durch schrittweise Abspaltung von Phenylgruppen aus Tetraphenylzinn mit Chlor hergestellt werden:[4]
Auch durch Komproportionierung von Tetraphenylzinn mit Zinntetrachlorid (Kocheshkov-Umlagerung) lässt sich Diphenylzinndichlorid herstellen:[4][5]
Eigenschaften
Physikalische Eigenschaften
Diphenylzinndichlorid löst sich leicht in Ether, Alkohol und Ligroin, im Wasser dagegen nur wenig unter teilweiser Zersetzung.[2] Im 13C-Kernresonansspektrum (NMR) zeigt Diphenylzinndichlorid folgende Signale:[6]
| Sn–C1– | –C2 | –C3 | –C4 | |
|---|---|---|---|---|
| ppm | 137,1 | 135,2 | 129,8 | 131,7 |
| J(13C–119Sn) | 785 | 64,7 | 86,3 | 17,5 |
Im 119Sn–NMR liefert es ein Signal bei −26,4 ppm. Im Kristall liegt der Zinn-Kohlenstoff-Abstand bei 2,112(5) und der Zinn-Chlor-Abstand bei 2,345(2) Å.[6] Es hat in Benzol ein Dipolmoment von 4,21 Debye.[7]
Chemische Eigenschaften
An feuchter Luft oder in Wasser hydrolysiert Diphenylzinndichlorid zu Diphenylzinnhydroxychlorid, aus welchem sich in Gegenwart von Salzsäure wieder Diphenylzinndichlorid zurückbildet:
Während in Gegenwart von Ammoniak oder Natronlauge Diphenylzinnoxid entsteht, werden durch Einwirkung von konzentrierten Säuren, wie Salzsäure Benzol oder entsprechende Substitutionsprodukte abgespalten:[2]
Verwendung
Durch Umsetzung von Diphenylzinndichlorid mit Diethylaluminiumhydrid in Diethylether kann Diphenylzinndihydrid gewonnen werden:[8]

Sicherheitshinweise
Diphenylzinndichlorid hat einen Flammpunkt von 113 °C.[1]
Einzelnachweise
- Datenblatt Diphenyltin dichloride bei Sigma-Aldrich, abgerufen am 22. September 2018 (PDF).
- B. Aronheim: Synthese der Zinnphenylverbindungen. In: Justus Liebig’s Annalen der Chemie. Band 194, Nr. 2-3, 1878, S. 145–175, doi:10.1002/jlac.18781940202.
- Phenylzinnverbindungen [MAK Value Documentation in German language, 2010]. In: The MAK Collection for Occupational Health and Safety. 31. Januar 2012, doi:10.1002/3527600418.mb240668verd0048.
- G. J. M. van der Kerk, J. G. A. Luijten, J. G. Noltes: Neue Ergebnisse der Organozinn-Forschung. In: Angewandte Chemie. Band 70, Nr. 10, 21. Mai 1958, S. 298–306, doi:10.1002/ange.19580701004.
- Alwyn George Davies: Organotin chemistry. Band 1. Wiley-VCH Verlag GmbH & Co. KGaA, 2004, ISBN 3-527-31023-1 (Seite 167 in der Google-Buchsuche).
- Cathrin Zeppek, Johann Pichler, Ana Torvisco, Michaela Flock, Frank Uhlig: Aryltin chlorides and hydrides: Preparation, detailed NMR studies and DFT calculations. In: Journal of Organometallic Chemistry. Band 740, September 2013, S. 41–49, doi:10.1016/j.jorganchem.2013.03.012.
- Jörg Lorberth, Heinrich Nöth: Dipolmomente einiger Organozinnchloride. In: Chemische Berichte. Band 98, Nr. 3, März 1965, S. 969, doi:10.1002/cber.19650980342.
- Wilhelm P. Neumann, Horst Niermann: Organozinnverbindungen, II. Darstellung von Organozinn-mono-, -di- und -tri-hydriden. In: Justus Liebigs Annalen der Chemie. Band 653, Nr. 1, 24. Mai 1962, S. 164, doi:10.1002/jlac.19626530119.

