Diphenylphosphan
Diphenylphosphan ist eine chemische Verbindung aus der Gruppe der Phosphane.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
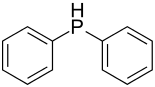 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Diphenylphosphan | |||||||||||||||
| Andere Namen |
Diphenylphosphin | |||||||||||||||
| Summenformel | C12H11P | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 186,19 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
280 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Brechungsindex |
1,626[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Herstellung
Diphenylphosphan kann durch die Hydrierung von Chlordiphenylphosphan mit Lithiumaluminiumhydrid erhalten werden.
Auch die Reaktion von Triphenylphosphan mit elementarem Lithium liefert Diphenylphosphan.[4]
- Reaktion von Triphenylphosphan mit Lithium zu Dipenylphosphan. Durch wässrige Aufarbeitung werden aus den lithiierten Verbindungen die Produkte freigesetzt. Ph = Phenyl
Eigenschaften
Diphenylphosphan ist eine farblose Flüssigkeit die bei −14,5 °C schmilzt und bei 280 °C siedet. Diphenylphosphan reagiert als sehr schwache Säure nur mit starken Basen zum Diphenylphosphid-Anion, das durch Mesomerie stabilisiert ist.
Verwendung
Das Anion von Diphenylphosphan (Ph2P−) kann durch die Umsetzung mit basischen Salzen von beispielsweise Kalium- oder Lithium erhalten werden. Das Anion kann als Nukleophil in Substitutionsreaktionen eingesetzt werden. Dieses wird beispielsweise zur Synthese von Phosphanliganden wie dppm[5] oder dppp[6] verwendet. Ähnlich wie Thiolate kann es zur Entschützung von aromatischen Methoxygruppen dienen, wobei signifikant mildere Bedingungen notwendig sind. So reicht bereits siedendes THF, wobei bei Thiolaten oft 150 °C vonnöten sind.
Einzelnachweise
- Datenblatt Diphenylphosphine bei Sigma-Aldrich, abgerufen am 3. November 2021 (PDF).
- E. Wiberg, M. van Ghemen, G. Müller-Schiedmayer: Neues aus der Chemie der Polyphosphane, in: Angew. Chem., 1963, 75, S. 814–823.
- H. R. Hudson, A. R. Qureshi, D. Ragoonanan: Factors in the formation of isomerically and optically pure alkyl halides. Part IX. Reactions of (1-substituted n-alkyl) diphenylphosphinites with hydrogen halides and with halogens, in: J. Chem. Soc., Perkin Trans. 1, 1972, S. 1595–1597.
- D. Wittenberg, H. Gilman: Lithium Cleavages of Triphenyl Derivatives of Some Group Vb Elements in Tetrahydrofuran, in: J. Org. Chem., 1958, 23, S. 1063–1065.
- E. N. Tsvetkov, N. A. Bondarenko, I. G. Malakhova, M. I. Kabachnik, in: Synthesis, 1986, 3, S. 198–208.
- M. T. Honaker, B. J. Sandefur, J. L. Hargett, A. L. McDaniel, R. N. Salvatore, in: Tetrahedron Lett., 2003, 44, 46, S. 8373–8378.

