Dimethyltrisulfid
Dimethyltrisulfid (DMTS) ist eine organische chemische Verbindung und das einfachste organische Trisulfid.[2][3] Es handelt sich um eine brennbare Flüssigkeit mit faulem Geruch.[4]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
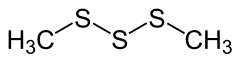 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Dimethyltrisulfid | ||||||||||||||||||
| Andere Namen |
Dimethyltrisulfan | ||||||||||||||||||
| Summenformel | C2H6S3 | ||||||||||||||||||
| Kurzbeschreibung |
gelbe Flüssigkeit mit pikantem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 126,26 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,203 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt |
−68 °C[1] | ||||||||||||||||||
| Siedepunkt |
165–175 °C[1] | ||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[1] | ||||||||||||||||||
| Brechungsindex |
1,600 (bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen

Dimethyltrisulfid wurde in flüchtigen Stoffen gefunden, die von gekochten Zwiebeln, Lauch und anderen Allium-Arten, von Brokkoli und Kohl sowie von Limburger Käse abgegeben werden,[5] und ist am ungenießbaren Aroma von gealtertem Bier und abgestandenem japanischem Sake beteiligt.[6] Es ist ein Produkt der bakteriellen Zersetzung, einschließlich der frühen Stadien der menschlichen Zersetzung,[7] und ein wichtiger Lockstoff für Schmeißfliegen auf der Suche nach Wirten. Dimethyltrisulfid wurde zusammen mit Dimethylsulfid und Dimethyldisulfid als flüchtige Verbindungen nachgewiesen, die von der Pflanze Helicodiceros muscivorus abgegeben werden. Sie lockt so Fliegen durch den Geruch von verwesendem Fleisch an. Die Fliegen tragen dann zur Bestäubung der Pflanze bei.[8] DMTS trägt zu dem üblen Geruch bei, den der Pilz Phallus impudicus, auch bekannt als Gemeiner Stinkmorchel, verströmt. Es verursacht auch den charakteristischen üblen Geruch von Pilzläsionen, z. B. von Krebswunden,[6] und trägt zum Geruch menschlicher Fäkalien bei.[9]
Chemische Reaktionen
DMTS kann unter anderem durch die Reaktion von Methanthiol mit Schwefelwasserstoff (in Gegenwart von Kupfer)[10] und mit Schwefeldichlorid[11] synthetisiert werden:[3]
Beim Erhitzen auf 80 °C zersetzt sich DMTS langsam zu einem Gemisch aus Dimethyldi-, -tri- und -tetrasulfiden.[11] Die Reaktivität von DMTS hängt mit seiner schwachen Schwefel-Schwefel-Bindung (ca. 45 kcal/mol) zusammen. Dimethyltetrasulfid, das thermisch reaktiver ist als Dimethyltrisulfid, hat eine noch schwächere (zentrale) Schwefel-Schwefel-Bindung (ca. 36 kcal/mol).[11] Die Oxidation von DMTS durch meta-Chlorperbenzoesäure (mCPBA) ergibt das entsprechende S-Monoxid, CH3S(O)SSCH3.
Verwendung
Dimethyltrisulfid enthaltende Fallenköder wurden zum Fang von Calliphora loewi und anderen Schmeißfliegen verwendet.[12] Dimethyltrisulfid hat sich in einem Nagetiermodell für Cyanidvergiftungen als wirksames Cyanid-Antidot sowohl gegen subkutanes Kaliumcyanid als auch gegen inhalierten Cyanwasserstoff erwiesen, da es Cyanid in viel weniger toxisches Thiocyanat umwandelt. Es wird vorgeschlagen, dass Dimethyltrisulfid bei einer Cyanid-Vergiftung mit Massenanfall von Verletzten eingesetzt werden kann. In Verbindung mit diesen Studien wurde die LD50 von Dimethyltrisulfid bei Mäusen auf 598,5 mg/kg festgelegt, was mit der LD50 von Kaliumcyanid von 8,0 mg/kg verglichen werden kann.[13]
Einzelnachweise
- Datenblatt Dimethyltrisulfid bei Alfa Aesar, abgerufen am 30. Dezember 2021 (Seite nicht mehr abrufbar).
- Edward L. Clennan, Kristina L. Stensaas: Recent Progress in the Synthesis, Properties and Reactions of Trisulfanes and Their Oxides. In: Organic Preparations and Procedures International. Band 30, Nr. 5, 1. Oktober 1998, S. 551–600, doi:10.1080/00304949809355321.
- Ralf Steudel: The Chemistry of Organic Polysulfanes R–Sn–R (n > 2). In: Chemical Reviews. Band 102, Nr. 11, 1. November 2002, S. 3905–3946, doi:10.1021/cr010127m.
- Mika Shirasu, Shunji Nagai, Ryuichi Hayashi, Atsushi Ochiai, Kazushige Touhara: Dimethyl trisulfide as a characteristic odor associated with fungating cancer wounds. In: Bioscience, Biotechnology, and Biochemistry. Band 73, Nr. 9, September 2009, S. 2117–2120, doi:10.1271/bbb.90229, PMID 19734656.
- Thomas H. Parliment, Michael G. Kolor, Donald J. Rizzo: Volatile components of Limburger cheese. In: Journal of Agricultural and Food Chemistry. Band 30, Nr. 6, 1. November 1982, S. 1006–1008, doi:10.1021/jf00114a001.
- Atsuko Isogai, Ryoko Kanda, Yoshikazu Hiraga, Toshihide Nishimura, Hiroshi Iwata: Screening and identification of precursor compounds of dimethyl trisulfide (DMTS) in Japanese sake. In: Journal of Agricultural and Food Chemistry. Band 57, Nr. 1, 14. Januar 2009, S. 189–195, doi:10.1021/jf802582p, PMID 19090758.
- M. Statheropoulos, A. Agapiou, C. Spiliopoulou, G. C. Pallis, E. Sianos: Environmental aspects of VOCs evolved in the early stages of human decomposition. In: Science of The Total Environment. Band 385, Nr. 1, 15. Oktober 2007, S. 221–227, doi:10.1016/j.scitotenv.2007.07.003.
- Marcus C. Stensmyr, Isabella Urru, Ignazio Collu, Malin Celander, Bill S. Hansson: Pollination: Rotting smell of dead-horse arum florets. In: Nature. Band 420, Nr. 6916, 12. Dezember 2002, S. 625–626, doi:10.1038/420625a, PMID 12478279.
- J. G. Moore, L. D. Jessop, D. N. Osborne: Gas-chromatographic and mass-spectrometric analysis of the odor of human feces. In: Gastroenterology. Band 93, Nr. 6, Dezember 1987, S. 1321–1329, doi:10.1016/0016-5085(87)90262-9, PMID 3678751.
- Mustapha Nedjma, Norbert Hoffmann: Hydrogen Sulfide Reactivity with Thiols in the Presence of Copper(II) in Hydroalcoholic Solutions or Cognac Brandies: Formation of Symmetrical and Unsymmetrical Dialkyl Trisulfides. In: Journal of Agricultural and Food Chemistry. Band 44, Nr. 12, 1. Januar 1996, S. 3935–3938, doi:10.1021/jf9602582.
- Timothy L. Pickering, K. J. Saunders, Arthur V. Tobolsky: Disproportionation of organic polysulfides. In: Journal of the American Chemical Society. Band 89, Nr. 10, 1. Mai 1967, S. 2364–2367, doi:10.1021/ja00986a021.
- Arne C. Nilssen, Bjørn Åge Tømmerås, Rudolf Schmid, Sissel Barli Evensen: Dimethyl trisulphide is a strong attractant for some calliphorids and a muscid but not for the reindeer oestrids Hypoderma tarandi and Cephenemyia trompe. In: Entomologia Experimentalis et Applicata. Band 79, Nr. 2, 1996, S. 211–218, doi:10.1111/j.1570-7458.1996.tb00828.x.
- Susan M. DeLeon, Jason D. Downey, Diane M. Hildenberger, Melissa O. Rhoomes, Lamont Booker: DMTS is an effective treatment in both inhalation and injection models for cyanide poisoning using unanesthetized mice. In: Clinical Toxicology. Band 56, Nr. 5, Mai 2018, S. 332–341, doi:10.1080/15563650.2017.1376749, PMID 28922956, PMC 6322672 (freier Volltext).

