Dimethylsilan
Dimethylsilan ist eine chemische Verbindung aus der Gruppe der siliciumorganischen Verbindungen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
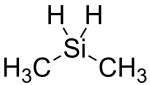 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Dimethylsilan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C2H8Si | |||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit widerlichem, süßlichen Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 60,17 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig[1] | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−19,6 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
hydrolysiert in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Dimethylsilan kann in quantitativer Ausbeute durch Umsetzung von Dichlorsilan mit einem Überschuss von gasförmigem Dimethylzink hergestellt werden.[2]
Auch durch Reduktion von Dichlordimethylsilan mit einem geeigneten Reduktionsmittel (z. B. Lithiumaluminiumhydrid) kann es gewonnen werden.
Eigenschaften
Dimethylsilan ist ein extrem entzündbares, farbloses Gas mit einem Flammpunkt ≤ −30 °C und einer Zündtemperatur von 205 °C. Es ist schwerer als Luft (relative Gasdichte= 2,11), bildet mit Luft explosive Gemische (untere Explosionsgrenze bei 1,2 Vol.-% bzw. 30 g·m−3, obere Explosionsgrenze bei 74 Vol.-% bzw. 1851 g·m−3) und kann sich an der Luft selbst entzünden.[1]
Es hydrolysiert in Wasser oder Säuren zu Dimethylsilandiol und Wasserstoff, der sich häufig sofort entzündet. Beim Ausströmen der Flüssigkeit oder beim Entweichen großer Gasmengen bilden sich kalte Nebel, die sich am Boden ausbreiten.
Verwendung
Als Präkursor-Molekül kann Dimethylsilan als Silicium-Quelle für die Abscheidung von Silicium-haltigen Schichten mittels chemischer Gasphasenabscheidung (CVD)[3] eingesetzt werden, die bei der Herstellung von Produkten in der Elektronik- und Photovoltaikindustrie benötigt werden, z. B. für Low-k-Dielektrika.[4]
Verwandte Verbindungen
Einzelnachweise
- Eintrag zu Dimethylsilan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Alfred Stock, Carl Somieski: Siliciumwasserstoffe VI.: Chlorierung und Methylierung des Monosilans. In: Berichte der deutschen chemischen Gesellschaft (A and B Series). Band 52, Nr. 4, 12. April 1919, S. 695, doi:10.1002/cber.19190520410.
- Air Liquide Gas Encyclopedia: Dimethylsilane (Memento vom 8. Juli 2012 im Internet Archive)
- Qingguo Wu, Karen K. Gleason: Plasma-enhanced chemical vapor deposition of low-k dielectric films using methylsilane, dimethylsilane, and trimethylsilane precursors. In: Journal of Vacuum Science & Technology A. Band 21, Nr. 2, März 2003, S. 388–393, doi:10.1116/1.1539086.

