Diketogulonsäure
L-Diketogulonsäure, kurz auch DKG, ist ein Reaktionsprodukt der Dehydroascorbinsäure.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
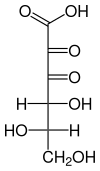 | |||||||||||||
| Fischer-Projektion von Diketogulonsäure | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Diketogulonsäure | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel |
| ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 192,12 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt |
140 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Modifikationen
Ähnlich wie Monosaccharide und Ascorbinsäure kann die Diketogulonsäure je nach Bedingungen als offenkettige oder als cyclische Acetal-Form vorliegen. Das offenkettige Tautomer kann weiterhin durch Wasseranlagerung an die beiden Keto-Gruppen geminale Diole bilden. Nachgewiesen sind hier sowohl das Mono-, als auch das Dihydrat.[3]
Reaktion und Bedeutung
In wässrigen Lösungen wird L-Diketogulonsäure durch Verseifung (Hydrolyse) aus Dehydroascorbinsäure (DHA) gebildet. Diketogulonsäure-Molekül neigt dazu, in wässrigen Lösungen mit im neutralen pH-Bereich in eine Vielzahl von Produkten weiter abgebaut zu werden.[4] So konnte man Erythroascorbinsäure,[5] L-Lyxon- und L-Xylonsäure,[6] L-Threoson (3,4-Dihydroxy-2-oxobutanal),[4] L-Threonsäure,[4] Oxalsäure und CO2 bei Decarboxylierungen nachweisen. Neben dem oxidativen Abbauweg gibt es auch einen nicht-oxidativen Abbau von DKG, was zu Oxalsäure und L-Erythrulose führt.[7]
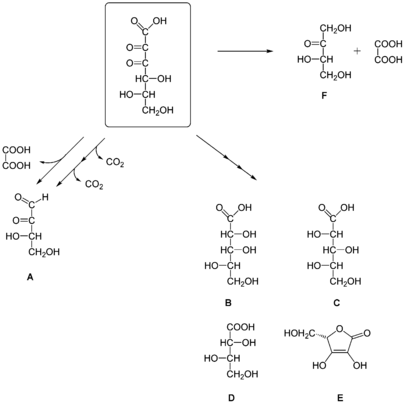
2001 konnte nachgewiesen werden, dass die Diketogulonsäure und zwei ihrer Abbauprodukte (3,4-Diketogulono-γ-lacton und 2,3-Diketogulono-γ-lacton) Proteine aus Eigelb gegen die Oxidation durch Kupferionen schützen.[8] Die Forscher führten dies auf die Anwesenheit der Endiol-Gruppe in beiden γ-Lactonen zurück, die damit strukturell und funktionell der Ascorbinsäure ähneln. Das 3,4-Diketogulono-γ-lacton erwies sich dabei als erheblich wirksamer.
Da Dehydroascorbinsäure oft bei der quantitativen Bestimmung von Vitamin C (Ascorbinsäure) als Reaktionsprodukt gemessen wird, kann die beschriebene Zerfallsreaktion die Messung verfälschen.
Einzelnachweise
- Peter M. Collins: Dictionary of Carbohydrates. CRC Press, 2005, ISBN 978-1-00-061156-4 (books.google.com).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- H. Trommer, R. H. H. Neubert: Ascorbinsäure: neue Erkenntnisse zur Wirkungsweise eines vielseitigen, antioxidativen Vitamins, Institut für Pharmazie der Martin-Luther-Universität Halle-Wittenberg.
- Nishikawa Y et al. (2001): Identification of 3,4-Dihydroxy-2-oxo-butanal (L-threosone) as an Intermediate Compound in Oxidative Degradation of Dehydro-L-ascorbic Acid and 2,3-Diketo-L-gulonic Acid in a Deuterium Oxide Phosphate Buffer. In: Bioscience, Biotechnology, and Biochemistry 65 (8), 1707–1712; PMID 11577707; doi:10.1271/bbb.65.1707; PDF (freier Volltextzugriff)
- Jung Ch. und Wells WW. (1998): Spontaneous conversion of L-dehydroascorbic acid to L-ascorbic acid and L-erythroascorbic acid. In: Archives of Biochemistry and Biophysics 355(1):9–14; PMID 9647661.
- Kanfer J. et al. (1960): Formation of l-Lyxonic and l-Xylonic Acids from l-Ascorbic Acid in Rat Kidney. In: J. Biol. Chem. 235; 2518–2521; PDF (freier Volltextzugriff).
- Simpson G. und Ortwerth BJ (2000): The non-oxidative degradation of ascorbic acid at physiological conditions. In: Biochim Biophys Acta. 1501(1):12–24; PMID 10727845.
- Li et al.(2001): Effects of 2,3-Diketo-L-Gulonic Acid on the Oxidation of Yolk Lipoprotein. In: Bioscience, Biotechnology, and Biochemistry 65(3), 599–604; PMID 11330674; doi:10.1271/bbb.65.599; PDF (freier Volltextzugriff).