Dihydroxyaceton
Dihydroxyaceton (abgekürzt DHA, Glyceron) ist ein einfach gebautes Kohlenhydrat mit der Summenformel C3H6O3. Es ist wesentlich am Kohlenhydratstoffwechsel beteiligt. DHA ist der wesentliche Inhaltsstoff von Selbstbräunern und reagiert mit Eiweißen in der Hornschicht – der obersten Hautschicht, die sich dabei bräunlich einfärbt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
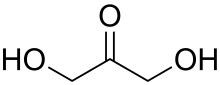 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Dihydroxyaceton | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C3H6O3 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 90,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,52 g·cm−3[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
gut in Wasser (930 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Darstellung
Dihydroxyaceton kann, ähnlich dem Glycerinaldehyd, durch Oxidation von Glycerin mit milden Oxidationsmitteln, wie verdünnter Wasserstoffperoxid-Lösung, in Anwesenheit von Eisensalzen als Katalysator, hergestellt werden. Die großtechnische Herstellung erfolgt biotechnologisch durch die mikrobielle Fermentation von Glycerin durch Gluconobacter oxydans in einer Größenordnung von etwa 2.000 t pro Jahr weltweit. Eine Alternative zu dieser relativ aufwendigen Technik ist die im Jahre 2007 veröffentlichte anodische Oxidation in Anwesenheit des Katalysators 2,2,6,6-Tetramethylpiperidinyloxyl (TEMPO).[4]
Eigenschaften
Dihydroxyaceton ist ein weißes, hygroskopisches Pulver mit charakteristischem Duft und süßem Geschmack. Es gehört zur Gruppe der Zucker und innerhalb dieser, wegen der drei C-Atome, aus denen das Molekül aufgebaut ist, zu den Triosen. Als einfachste denkbare Ketose besitzt das Molekül kein Chiralitätszentrum und ist optisch inaktiv. Dihydroxyaceton liegt im festen Zustand gewöhnlich als Dimer vor, das sich nach Lösen in Wasser schnell in das Monomer spaltet. Diese Reaktion verläuft nach einem Zeitgesetz erster Ordnung. Die Halbwertszeit beträgt bei Raumtemperatur 20,4 min.[5]

Biologische Bedeutung
Von besonderer Bedeutung in der Biochemie ist ein Phosphorsäure-Ester des Dihydroxyacetons, das Dihydroxyacetonphosphat (hier als Dianion abgebildet, wie es gewöhnlich unter physiologischen Bedingungen auftritt).
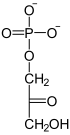
Seine Bedeutung in der Stoffwechselphysiologie liegt darin, dass es zum wichtigen Glycerinaldehyd-3-phosphat isomerisiert wird. Diese Isomerisierung verläuft basen-katalysiert über die Lobry-de-Bruyn-Alberda-van-Ekenstein-Umlagerung. In folgender Abbildung steht der Rest R für die Gruppe –CH2–OH:

Wie ihre Phosphorsäureester sind auch Dihydroxyaceton und Glycerinaldehyd zueinander isomer. Sie stehen durch die oben abgebildete Umlagerung im chemischen Gleichgewicht. In der Zelle werden diese Gleichgewichtsreaktionen durch bestimmte Enzyme katalysiert. In Bakterien wird Dihydroxyaceton durch die Glycerin-Dehydrogenase gebildet.
Weblinks
Einzelnachweise
- Marina Bährle-Rapp: Springer Lexikon Kosmetik und Körperpflege, Springer-Verlag Berlin, Heidelberg, 5. Auflage, 2020, ISBN 978-3-662-59126-0, S. 157.
- Datenblatt Dihydroxyaceton bei Merck, abgerufen am 20. Dezember 2018.
- Eintrag zu 1,3-Dihydroxyaceton in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18. November 2022. (JavaScript erforderlich)
- Mario Pagliaro, Rosaria Ciriminna, Hiroshi Kimura, Michele Rossi, Christina Della Pina: Von Glycerin zu höherwertigen Produkten, in: Angewandte Chemie, 2007, Bd. 119, S. 4516–4522 (doi:10.1002/ange.200604694).
- Leodis Davis: The structure of dihydroxyacetone in solution, in: Bioorg. Chem., 1973, Bd. 2, S. 197–201 (doi:10.1016/0045-2068(73)90023-0).