Dihydromyricetin
Dihydromyricetin (DHM), auch Ampelopsin genannt, ist ein Flavanonol aus der Gruppe der Flavonoide.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
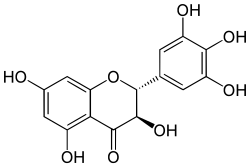 | ||||||||||||||||
| (+)-Dihydromyricetin | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Dihydromyricetin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C15H12O8 | |||||||||||||||
| Kurzbeschreibung |
weiße nadelförmige Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 320,25 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Vorkommen

Als sekundärer Pflanzenstoff ist Dihydromyricetin unter anderem im Japanischen Rosinenbaum (Hovenia dulcis),[1] in Pflanzen aus der Gattung Ampelopsis, beispielsweise in A. meliaefolia,[4] A. japonica,[1] A. megalophylla,[1] A. cantoniensis (= A. grossedentata),[1] in der Küsten-Kiefer (Pinus contoria),[5] in Erythrophleum africanum,[2] im Rhododendron cinnabarinum,[1] und im Japanischen Kuchenbaum (Cercidiphyllum japonicum)[1] enthalten.
Pharmakologie
Dihydromyricetin bindet an den GABAA-Rezeptor. An diesen Nervenzellrezeptor bindet beispielsweise auch Alkohol. Im Tiermodell Farbratte konnte gezeigt werden, dass alkoholisierte Tiere, denen zuvor eine Dosis von 1 mg/kg Körpergewicht DHM verabreicht wurde, deutlich schneller wieder nüchtern wurden. In weiteren Versuchen konnten potentiell den Alkoholentzug fördernde Eigenschaften festgestellt werden. Ratten, denen beliebige Mengen an Alkohol zu Verfügung steht, konsumieren über die Zeit immer größere Mengen Alkohol; ein typisches Zeichen von Suchtverhalten. In einer Versuchsreihe wurde den Tieren nach sieben Wochen DHM in den Alkohol beigemischt, worauf sich der Alkoholkonsum deutlich reduzierte. Es wurde das Niveau erreicht, das die Versuchstiere hatten, denen DHM von vornherein mit Alkohol verabreicht wurde.[6]
Bei den eingesetzten Wirkstoffmengen konnten keine durch das DHM hervorgerufenen toxikologischen Effekte bei den Versuchstieren nachgewiesen werden. Erst beim 100-fachen der in den Versuchen eingesetzten Dosis zeigten die Ratten leichte Orientierungsstörungen, die beispielsweise auch durch Benzodiazepine hervorgerufen werden, die ebenfalls an den GABAA-Rezeptor binden.[6]
Eine leberprotektive Wirkung von DHM wird aufgrund diverser Studien an Mäusen angenommen.[7][8][9] Extrakte des Japanischen Rosinenbaums sind von der Korea Food & Drug Administration seit 2008 zur Regeneration der Leber von Patienten mit Alkoholabusus zugelassen. Die Wirkung ist schon seit über 500 Jahren bekannt.[10]
Weiterführende Literatur
- X. Kou, K. Shen u. a.: Ampelopsin Inhibits H(2) O(2) -induced Apoptosis by ERK and Akt Signaling Pathways and Up-regulation of Heme Oxygenase-1. In: Phytotherapy Research. [elektronische Veröffentlichung vor dem Druck] Dezember 2011, doi:10.1002/ptr.3671. PMID 22144097.
- J. Ye, Y. Guan u. a.: Ampelopsin prevents apoptosis induced by H2O2 in MT-4 lymphocytes. In: Planta Medica. Band 74, Nummer 3, Februar 2008, S. 252–257, doi:10.1055/s-2008-1034317. PMID 18300190.
- L. P. Ruan, B. Y. Yu u. a.: Improving the solubility of ampelopsin by solid dispersions and inclusion complexes. In: Journal of Pharmaceutical and Biomedical Analysis. Band 38, Nummer 3, Juli 2005, S. 457–464, doi:10.1016/j.jpba.2005.01.030. PMID 15925247.
- Y. Zhang, S. Que u. a.: Isolation and identification of metabolites from dihydromyricetin. In: Magnetic Resonance in Chemistry. Band 45, Nummer 11, 2007, S. 909–916. doi:10.1002/mrc.2051
- D. J. Peters, C. P. Constabel: Molecular analysis of herbivore-induced condensed tannin synthesis: cloning and expression of dihydroflavonol reductase from trembling aspen (Populus tremuloides). In: The Plant Journal. Band 32, Nummer 5, 2002, S. 701–712. doi:10.1046/j.1365-313X.2002.01458.x
- 3,3′,4′,5,5′,7-Hexahydroxy-2,3-Dihydro-Flavanonol 27200-12-0. In: Sax's Dangerous Properties of Industrial Materials. doi:10.1002/0471701343.sdp13587
Einzelnachweise
- J. Zhou, G. Xie, X. Yan: Encyclopedia of Traditional Chinese Medicines. Verlag Springer, 2011, ISBN 3-642-16734-9, S. 123. eingeschränkte Vorschau in der Google-Buchsuche
- R. Hänsel, J. Klaffenbach: Optisch aktives Dihydromyricetin aus Erythrophleum africanum. Band 294, Nummer 3, 1961, S. 158–172, doi:10.1002/ardp.19612940306
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- R. Hegnauer: Chemotaxonomie der Pflanzen. Verlag Birkhäuser, 1973, ISBN 3-764-30667-X, S. 639. eingeschränkte Vorschau in der Google-Buchsuche
- J. W. Rowe, J. H. Scroggins: Benzene Extractives of Lodgepole Pine Bark. Isolation of New Diterpenes. In: J Org Chem. Band 29, Nummer 6, 1964, S. 1554–1562. doi:10.1021/jo01029a068
- Y. Shen, A. K. Lindemeyer u. a.: Dihydromyricetin as a novel anti-alcohol intoxication medication. In: The Journal of neuroscience. Band 32, Nummer 1, Januar 2012, S. 390–401, doi:10.1523/JNEUROSCI.4639-11.2012. PMID 22219299.
- K. Hase, M. Ohsugi u. a.: Hepatoprotective effect of Hovenia dulcis THUNB. on experimental liver injuries induced by carbon tetrachloride or D-galactosamine/lipopolysaccharide. In: Biological and Pharmaceutical Bulletin. Band 20, Nummer 4, April 1997, S. 381–385, PMID 9145214.
- H. L. Fang, H. Y. Lin u. a.: Treatment of chronic liver injuries in mice by oral administration of ethanolic extract of the fruit of Hovenia dulcis. In: The American journal of Chinese medicine. Band 35, Nummer 4, 2007, S. 693–703, PMID 17708635.
- T. Murakami, M. Miyakoshi u. a.: Hepatoprotective activity of tocha, the stems and leaves of Ampelopsis grossedentata, and ampelopsin. In: BioFactors. Band 21, Nummer 1–4, 2004, S. 175–178, PMID 15630194.
- D. Mitchell: Chinese Herbal Hangover Remedy May Fight Alcoholism. (Memento des vom 22. Januar 2021 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: EmaxHealth. Abgerufen am 9. Januar 2012.
Weblinks
- J. Dönges: Neuer Wirkstoff hemmt die Wirkung von Alkohol. In: Handelsblatt vom 11. Januar 2012 (siehe auch spektrum.de)