Dihydrojasmon
Dihydrojasmon ist eine von Jasmon abgeleitete chemische Verbindung. Es ist eine farblose Flüssigkeit mit charakteristischem Geruch, die in Parfüms als blumiger und fruchtiger Geruchsstoff (jasminartig) eingesetzt wird.[5]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
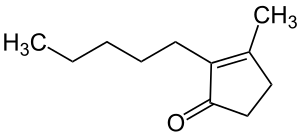 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Dihydrojasmon | ||||||||||||||||||
| Andere Namen |
3-Methyl-2-pentyl-2-cyclopenten-1-on | ||||||||||||||||||
| Summenformel | C11H18O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 166,26 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
0,916 g·cm−3 (25 °C)[2] | ||||||||||||||||||
| Siedepunkt |
120–121 °C (12 mmHg)[2] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,4767 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Darstellung
Die Synthese von Dihydrojasmon wurde erstmals 1942 von Heinz Hunsdiecker beschrieben. Bei der Hunsdiecker-Kondensation wird 2,5-Undecandion in siedendem Ethanol mit 2-prozentiger wässriger Natronlauge als Katalysator cyclisiert.[6][7]
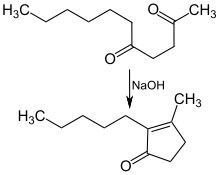
Cyclisierung von 2,5-Undecandion zu Dihydrojasmon
2,5-Undecandion ist durch Spaltung von 2-Hexyl-5-methylfuran zugänglich, das über eine mehrstufige Reaktionssequenz mit schlechter Ausbeute aus 5-Methylfurfural[8] gewonnen werden kann.[6] Ein Alternativverfahren für die Herstellung von 2,5-Undecandion geht von n-Heptanal aus, wobei die Carbonylgruppe mit 1,3-Propandithiol als Dithian geschützt wird. Nach Alkylierung und Abspaltung der Schutzgruppe erhält man die Ausgangsverbindung für die Dihydrojasmon-Synthese.[9]
Eine technisch einfache Synthese von Dihydrojasmon geht von n-Heptylamin aus, welches mit Ozon bei −78 °C zum 1-Nitroheptan oxidiert wird. Dieses wird in Chloroform gelöst und mit katalytischen Mengen Diisopropylamin bei 40 °C mit Methylvinylketon umgesetzt und anschließend mit basischem Silicagel zur Trockene eingedampft und 48 Stunden bei 80 °C zum Endprodukt umgesetzt.[10]
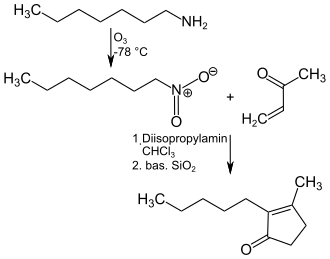
Synthese von Dihydrojasmon aus n-Heylamin und Methylvinylketon
Alternative Syntheserouten verwenden als Ausgangskomponente 2-Methylfuran[11] oder Acrylsäuremethylester.[12]
Einzelnachweise
- Eintrag zu DIHYDROJASMONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 1. Oktober 2021.
- Datenblatt Dihydrojasmone, ≥98%, stabilized, FG bei Sigma-Aldrich, abgerufen am 26. Dezember 2019 (PDF).
- Datenblatt bei TheGoodScents
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-366.
- Karl‐Georg Fahlbusch, Franz‐Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe, Horst Surburg: Flavors and Fragrances. In: Ullmann’s Encyclopedia of Industrial Chemistry. Band 15, 2012, S. 73–198, doi:10.1002/14356007.a11_141.
- Heinz Hunsdiecker: Über das Verhalten der γ-Diketone, I. Mitteilung. In: Berichte der deutschen chemischen Gesellschaft. Band 75, Nr. 5, 6. Mai 1942, S. 447–454, doi:10.1002/cber.19420750502.
- Patent US2387587: Process of manufacturing cyclopentenone derivatives. Angemeldet am 20. August 1940, veröffentlicht am 23. Oktober 1945, Erfinder: Heinz Hunsdiecker.
- Externe Identifikatoren von bzw. Datenbank-Links zu 5-Methylfurfural: CAS-Nummer: 620-02-0, EG-Nummer: 210-622-6, ECHA-InfoCard: 100.009.658, GESTIS-Stoffdatenbank: 493494, PubChem: 12097, ChemSpider: 11600, Wikidata: Q22830264.
- Tse-Lok Ho, Honor C. Ho, C. M. Wong: A Synthetic Route to Dihydrojasmone; Sulfuric Acid as Dethioacetalization Agent. In: Canadian Journal of Chemistry. 51 (2), 1973, S. 153–155, doi:10.1139/v73-023.
- Ehud Keinan, Yehuda Mazur: Reactions in dry media. A simple conversion of nitro groups into carbonyls. In: Journal of the American Chemical Society. Band 99, Nr. 11, März 1977, S. 3861, doi:10.1021/ja00453a067.
- Janusz Nowicki: Review: Synthesis of Jasmonoides from Furan Derivatives, in: Molecules, 2000, 5, S. 1201–1209.
- G. W. Parshall, W. A. Nugent, D. M.-T. Chan, W. Tam: A new role for organometallic reactions in organic synthesis in industry (PDF; 220 kB), in: Pure Appl. Chem., 1985, 57 (12), S. 1809–1818.