Oxidation durch hypervalente Iod-Reagenzien
Die Oxidation durch hypervalente Iod-Reagenzien umfasst die Dess-Martin-Oxidation und die IBX-Oxidation. Dies sind chemische Reaktionen und beschreiben die Oxidation von primären oder sekundären Alkoholen durch die Oxidationsmittel IBX (2-Iodoxybenzoesäure) bzw. Dess-Martin-Periodinan.
IBX-Oxidation
Die IBX-Oxidation wird in der Organischen Chemie dazu verwendet, primäre Alkohole zu Aldehyden zu oxidieren. 2-Iodoxybenzoesäure, kurz IBX, ist ein hitze- und stoßempfindliches Molekül. Zudem lässt es sich in vielen Lösungsmitteln nicht lösen.
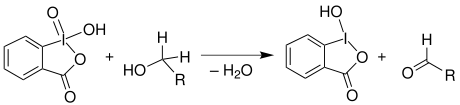
Mechanismus
Die Reaktion verläuft in zwei Teilschritten. Zunächst greift der zu oxidierende Alkohol nukleophil am Iod-Atom des IBX 1 an, wobei ein Wassermolekül abgespalten wird. Hierauf folgen die auf der Abbildung durch Pfeile dargestellten Elektronen-Umlagerungen. Auf diese Weise wird die Bindung des ehemaligen primären Alkohols zum Iod-Atom gebrochen, das dadurch reduziert wird. Der eingesetzte Alkohol wird hierbei zum entsprechenden Aldehyd 4 oxidiert.

Dess-Martin-Oxidation
Die Dess-Martin-Oxidation ist eine Namensreaktion der Organischen Chemie und benannt nach den amerikanischen Chemikern Daniel Benjamin Dess und James Cullen Martin. Die Reaktion dient zur Oxidation von primären und sekundären Alkoholen zu Aldehyden bzw. Ketonen. Als Oxidationsmittel wird das Dess-Martin-Periodinan verwendet. Es wird hergestellt, indem IBX in DMSO mit Hilfe von Essigsäureanhydrid zum Dess-Martin-Periodinan reagiert.[1]
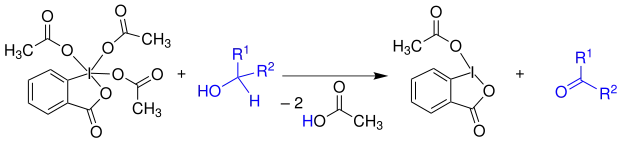
Mechanismus
Die Reaktion verläuft ähnlich wie bei der IBX-Oxidation. Zu Beginn wird das Iod-Atom der Verbindung 1 vom Alkohol nukleophil unter Abspaltung eines Moleküls Essigsäure (AcOH) angegriffen. In einer α-H-Eliminierung wird nun der Alkohol unter Freisetzung eines weiteren Moleküls Essigsäure oxidiert. Das Iodatom wird hierbei von der Oxidationsstufe +V auf +III reduziert.[2] Es ist bestrebt, Elektronen aufzunehmen und fungiert daher hier als Elektronensenke. Es entsteht ein Keton 4.[3]

Vor allem ist die Dess-Martin-Oxidation eine sehr selektive und milde Oxidation, die eine Alternative zur Swern-Oxidation, Jones-Oxidation oder Pfitzner-Moffatt-Oxidation darstellt, jedoch zu den Reaktionen zählt, die mit geringer Atomökonomie ablaufen.
Reaktionsbedingungen
Typischerweise kann die Umsetzung bei Raumtemperatur in einem Lösungsmittel wie Chloroform oder Dichlormethan unter Einsatz von nur 1,1 Äquivalenten des Periodinan-Reagenz durchgeführt werden. Die Reaktionszeit beträgt etwa 0,5 h bis 2 h. Die Aufarbeitung erfolgt mittels basischer Hydrolyse.[4] Eine neuere Variante nutzt als Lösungsmittel die ionische Flüssigkeit Butylmethylimidazoliumtetrafluoroborat (BMIM BF4).[5]
Einzelnachweise
- D. B. Dess, J. C. Martin: Readily accessible 12-I-5 oxidant for the conversion of primary and secondary alcohols to aldehydes and ketones in J. Org. Chem. 48 (1983) 4155-4156. doi:10.1021/jo00170a070.
- P. J. Stang, V. V. Zhdankin: Organic Polyvalent Iodine Compounds in Chem. Rev. 96 (1996) 1123–1178. doi:10.1021/cr940424+.
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis; Elsevier Academic Press, Burlington-San Diego-London 2005, 1. Edition; ISBN 0-12-369483-3.
- S. D. Meyer, S. L. Schreiber: Acceleration of the Dess-Martin Oxidation by Water in J. Org. Chem. 59 (1994) 7549-7552. doi:10.1021/jo00103a067.
- J. S. Yadav, B. V. S. Reddy, A. K. Basak, A. V. Narsaiah: Recyclable 2nd generation ionic liquids as green solvents for the oxidation of alcohols with hypervalent iodine reagents in Tetrahedron 60 (2004) 2131–2135. doi:10.1016/j.tet.2003.12.056.