Cyclophosphamid
Das Oxazaphosphinan Cyclophosphamid (Handelsname: Endoxan, Hersteller: Baxter) ist ein Arzneistoff und zählt zu der Gruppe der Stickstoff-Senfgas-Verbindungen mit alkylierender Wirkung. Es handelt sich dabei um ein Zytostatikum. Außer für die Krebstherapie wird es auch zur Behandlung von besonders schweren Verläufen bei Autoimmunerkrankungen wie systemischem Lupus Erythematodes (SLE), Sklerodermie, Dermatomyositis (MDA5 pos.), Vaskulitiden wie der Granulomatose mit Polyangiitis, Rheumatoider Arthritis sowie experimentell bei Multipler Sklerose eingesetzt. Da Cyclophosphamid erst nach einer Aktivierung in der Leber zytotoxisch wirkt, ist es ein Prodrug.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
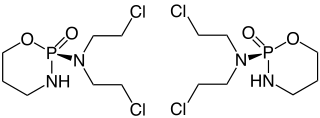 | ||||||||||||||||||||||
| 1:1-Gemisch aus (R)-Form (links) und (S)-Form (rechts) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Cyclophosphamid | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel |
| |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L01AA01 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 279,1 g·mol−1 (Monohydrat) | |||||||||||||||||||||
| Aggregatzustand |
fest (Monohydrat)[1] | |||||||||||||||||||||
| Schmelzpunkt |
41–45 °C und 47–49 °C (Monohydrat)[1] | |||||||||||||||||||||
| Löslichkeit |
gut löslich in Wasser (40 g·l−1 bei 20 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Geschichte
Die Chemiker von Asta Medica synthetisierten auf der Suche nach einem Krebspräparat Derivate des Phosphamidmustards. Das spätere Cyclophosphamid wurde 1956 gefunden[3] und 1962 patentiert.[4]
Herstellung
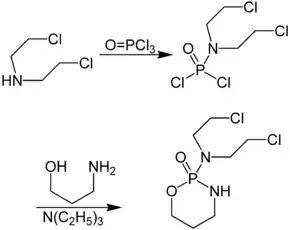
Cyclophosphamid wird aus Bis(2-chlorethyl)amin und Phosphor(V)-oxychlorid hergestellt. Das entstehende Phosphorsäureamiddichlorid liefert bei der Umsetzung mit 3-Amino-1-propanol in Gegenwart von Triethylamin racemisches Cyclophosphamid.[5]
Pharmakologie
Cyclophosphamid an sich ist eine nicht zytostatisch wirksame Substanz. Bei Aufnahme in den Körper und Passage mittels Blutkreislaufes durch die Leber wird es in dieser aktiviert. Die Bioverfügbarkeit beträgt zwischen 70 und 90 % nach peroraler Gabe, die Eliminationshalbwertzeit ist 3–12 Stunden. Durch Enzyme des Cytochrom-P450-Systems (insbesondere CYP2B6[6]) wird Cyclophosphamid durch Hydroxylierung zu 4-Hydroxycyclophosphamid (4-OH-Cyclophosphamid). 4-OH-Cyclophosphamid liegt mit dem Tautomer Aldophosphamid in einem Gleichgewicht vor.

Aldophosphamid spaltet spontan Acrolein ab und wird zu Phosphoramidmustard (Chlorethylphosphorsäureamid[7]). Das Phosphoramidmustard ist ein aktives bifunktionales Alkylans und ein Zwitterion bei physiologischem pH (7,4): Die Form Phosphoramidmustard gelangt nur schwerlich über die Zellmembran in Zellen, die Form 4-OH-Cyclophosphamid-Aldophosphamid gelangt recht leicht durch die Zellmembran in die Zellen. 4-OH-Cyclophosphamid-Aldophosphamid dient somit als Transportmittel von Phosphoramidmustard in die Zellen; letzteres ist deutlich zytotoxischer als 4-OH-Cyclophosphamid-Aldophosphamid. Analog der Substanz Mechlorethamin bewirkt Phosphoramidmustard in Zellen Vernetzungsverbindungen zwischen den einzelnen DNA-Strängen (DNA-Vernetzung).
Aldehyddehydrogenasen bauen 4-OH-Cyclophosphamid ab, in dem sie es zu Carboxyphosphamid oxidieren. Zellen, die reich an Aldehyddehydrogenasen sind wie beispielsweise frühe hämatopoetische Stammzellen und Megakaryozyten wie auch Stammzellen in den Schleimhäuten sind gegenüber den toxischen Wirkungen von 4-OH-Cyclophosphamid und Phosphoramid-Mustard unempfindlicher als Zellen ohne reichliche Ausstattung mit Aldehyddehydrogenasen. Dieser Unterschied in der Metabolisierungsfähigkeit erklärt die relativ kurze Dauer der Knochenmarktoxizität mit Anämie, Thrombopenie und Leukopenie. Sie erklärt auch die im Vergleich zu anderen alkylierenden Substanzen geringere Schleimhauttoxizität (Mukositis).
Wirksamkeit
Krebserkrankungen
Cyclophosphamid wird bei einer Reihe von bösartigen Erkrankungen (Krebserkrankungen) als Zytostatikum eingesetzt. Zumeist erfolgt der Einsatz in Kombination mit anderen Zytostatika. Cyclophosphamid ist nach der Metabolisierung nicht mehr zellmembrangängig, d. h. der Wirkstoff verbleibt in den Zellen.
Erwachsene
- Mammakarzinom (CMF-Schema: Cyclophosphamid, Methotrexat, 5-Fluoruracil)
- Weichteilsarkome
- Hodgkin-Lymphom
- Non-Hodgkin-Lymphom
- Ewing-Sarkom
- Konditionierungsbehandlung vor Stammzelltransplantation und Immuntherapie
- Mobilisierung von Stammzellen zur Stammzellapherese
Kinder und Jugendliche
- Medulloblastom[8]
- Weichteilsarkome wie Rhabdomyosarkom, Leiomyosarkom
- Akute lymphoblastische Leukämie – in Kombination mit Cytarabin oder Methotrexat und Asparaginase
- Hodgkin-Lymphom
- Non-Hodgkin-Lymphom
- Neuroblastom
- Retinoblastom
- Ewing-Sarkom
- Konditionierungsbehandlung vor Stammzelltransplantation
- Mobilisierung von Stammzellen zur Stammzellapherese
- Schwere und sehr schwere aplastische Anämie
Multiple Sklerose
In mehreren Studien konnte eine Reduzierung der Progression bei guter Verträglichkeit beobachtet werden.[9][10] Dabei waren Auffrischinfusionen besser wirksam als eine einmalige Induktionstherapie.
Für die Behandlung von Multipler Sklerose mit Cyclophosphamid liegt derzeit keine Zulassung vor.
Wirkmechanismus
Cyclophosphamid führt zu Einzel- und Doppelstrangbrüchen in sich schnell teilenden Zellen. Daraus resultierend finden sich im Blut von behandelten Patienten mehr CD8-Suppressorzellen und weniger CD4-Helferzellen.
Nebenwirkungen
Es kommt häufig zu einer verminderten Leukozytenzahl (Dosislimitierende Knochenmarkdepression), Übelkeit, Haarausfall. Besonders bei hohen kumulierten Dosen ist das Krebsrisiko, speziell für Leukämie und Blasentumoren erhöht. Außerdem kann es im Rahmen einer Chemotherapie mit Cyclophosphamid zu einer hämorrhagischen Zystitis kommen. Dagegen wird eine protektive Substanz parallel zur Cyclophosphamid Gabe verabreicht: Mesna (Mercapto-ethansulfonat-Natrium). Allerdings ist die Sinnhaftigkeit der Gabe von Mesna durchaus umstritten, vor allem bei Cyclophosphamidtherapien im nicht-onkologischen Bereich (zum Beispiel bei der Therapie der Granulomatose mit Polyangiitis), da hier die verwendeten Dosierungen deutlich geringer sind.[11]
Weiterhin kann es nach Cyclophosphamidgabe bei Frauen und Männern zu Infertilität kommen, weswegen eine Kryokonservierung von Spermien bzw. Eizellen vor Erstgabe erwogen werden sollte. Impfungen mit Totimpfstoffen sind unter Cyclophosphamid-Behandlung aufgrund dessen immunsuppressiver und zytostatischer Wirkung nicht wirksam.
Gegenanzeigen (Kontraindikationen)
- Schwangerschaft. Eine Schwangerschaft sollte vor der Cyclophosphamid-Therapie ausgeschlossen werden, eine bestehende Schwangerschaft ist eine Gegenanzeige (Kontraindikation) für den Einsatz von Cyclophosphamid. Während der Therapie sollte ausreichende Verhütungsmaßnahmen angewendet werden, um eine Schwangerschaft zu verhindern.
- Impfungen mit Lebendimpfstoffen. Infolge der zytostatischen und immunsuppressiven Wirkung sind Impfungen mit Lebendimpfstoffen während einer Behandlung mit Cyclophosphamid potentiell gefährlich und sollten daher unterlassen werden.
Bedeutung für die Psychoneuroimmunologie
Die Konditionierbarkeit des Immunsystems wurde erstmals von Robert Ader (1932–2011) mit Cyclophosphamid als unkonditioniertem Stimulus nachgewiesen.[12] Er konnte in Rattenexperimenten eine klassisch-konditionierte immunsuppressive Wirkung der Substanz nachweisen. Zuerst wurde eine Saccharin-Lösung (neutraler Stimulus) gepaart mit Cyclophosphamid dargeboten. Nach Gabe von gesüßtem Wasser wurde den Tieren das Übelkeit auslösende Immunsuppressivum injiziert. In der Folge wurde neben einer konditionierten Geschmacksaversion gegen die Saccharin-Lösung eine verringerte Antikörperproduktion und eine erhöhte Mortalität bei den konditionierten Versuchstieren festgestellt. D. h. der Süßstoff, der ursprünglich keinen Einfluss auf die Immunfunktion hatte, löste nach dem Konditionierungslernen vergleichbare immunsuppressive Wirkungen wie Cyclophosphamid aus. Mit diesen Befunden begründete Ader die sogenannte Psychoneuroimmunologie, die sich mit den Einflüssen psychischer und neuronaler Mechanismen auf das Immunsystem (im Besonderen auf die Immunabwehr) beschäftigt.
Weblinks
- Monograph Cyclophosphamid British Columbia Cancer Agency (Memento vom 30. Oktober 2007 im Internet Archive) Frei zugänglich. Stand 08/2006.
- US-amerikanische Fachinformation Cyclophosphamid (Memento vom 11. April 2008 im Internet Archive) Stand: 07/2000. Frei zugänglich.
Einzelnachweise
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 460, ISBN 978-0-911910-00-1.
- Eintrag zu Cyclophosphamid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Mechtild Wolf (Hrsg.): Immer eine Idee besser: Forscher und Erfinder der Degussa; Frankfurt am Main, Degussa AG 1998 (S. 172 f.)
- Eintrag zu Cyclophosphamid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 23. Januar 2015.
- Axel Kleemann, Jürgen Engel, Bernd Kutscher und Dietmar Reichert: Pharmaceutical Substances, 4. Auflage (2000), 2 Bände erschienen im Thieme-Verlag Stuttgart, S. 563, ISBN 978-1-58890-031-9; seit 2003 online mit halbjährlichen Ergänzungen und Aktualisierungen.
- T. K. Chang, G. F. Weber u. a.: Differential activation of cyclophosphamide and ifosphamide by cytochromes P-450 2B and 3A in human liver microsomes. In: Cancer Research. Band 53, Nummer 23, Dezember 1993, S. 5629–5637, PMID 8242617.
- Klaus Aktories, Ulrich Förstermann, Franz Bernhard Hofmann, Klaus Starke (Hrsg.): Allgemeine und Spezielle Pharmakologie und Toxikologie. Begründet von W. Forth, D. Henschler, W. Rummel. 10. Auflage. Urban & Fischer in Elsevier, München 2009, ISBN 978-3-437-42522-6.
- S1-Leitlinie Medulloblastom im Kindes- und Jugendalter der Gesellschaft für Pädiatrische Onkologie und Hämatologie (GPOH). In: AWMF online (Stand 11/2012)
- C. Krishnan, A. I. Kaplin u. a.: Reduction of disease activity and disability with high-dose cyclophosphamide in patients with aggressive multiple sclerosis. In: Archives of neurology. Band 65, Nummer 8, August 2008, S. 1044–1051, doi:10.1001/archneurol.65.8.noc80042, PMID 18541787, PMC 2574697 (freier Volltext).
- D. M. Harrison, D. E. Gladstone u. a.: Treatment of relapsing-remitting multiple sclerosis with high-dose cyclophosphamide induction followed by glatiramer acetate maintenance. In: Multiple sclerosis. Band 18, Nummer 2, Februar 2012, S. 202–209, doi:10.1177/1352458511419701, PMID 21865410, PMC 3612927 (freier Volltext).
- P. A. Monach, L. M. Arnold, P. A. Merkel: Incidence and prevention of bladder toxicity from cyclophosphamide in the treatment of rheumatic diseases: a data-driven review. In: Arthritis and rheumatism. Band 62, Nummer 1, Januar 2010, S. 9–21, doi:10.1002/art.25061, PMID 20039416 (Review).
- R. Ader, N. Cohen: Behaviorally conditioned immunosuppression. In: Psychosomatic medicine. Band 37, Nummer 4, 1975, S. 333–340, PMID 1162023.