Cycloheptanon
Cycloheptanon ist eine chemische Verbindung aus der Gruppe der Ketone.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
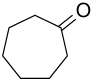 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cycloheptanon | |||||||||||||||
| Andere Namen |
Suberon | |||||||||||||||
| Summenformel | C7H12O | |||||||||||||||
| Kurzbeschreibung |
entzündliche farblose Flüssigkeit mit fruchtigem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 112,17 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,95 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
179 °C[1] | |||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Brechungsindex |
1,461 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Gewinnung und Darstellung
Cycloheptanon wurde erstmals 1836 durch den französischen Chemiker Jean-Baptiste Boussingault ausgehend vom Calciumsalz der dibasischen Korksäure (Calciumsuberat) dargestellt. Aus diesem erhielt er durch Erhitzen („trockene Destillation“) Calciumcarbonat und Cycloheptanon:[4]
Cycloheptanon kann auch durch Cyclisierung und Decarboxylierung von Korksäure oder deren Estern gewonnen werden.[5]
Die Synthese ist auch durch eine Reaktion ausgehend von Cyclohexanon mit Natriumethanolat und Nitromethan und nachfolgender Reaktion mit Essigsäure und Natriumnitrit möglich.[6]
Weiterhin kann es durch Ringerweiterung von Cyclohexanon mit Diazomethan gewonnen werden.[6]
Eigenschaften
Cycloheptanon ist eine entzündliche farblose Flüssigkeit mit fruchtigem Geruch, welche praktisch unlöslich in Wasser ist.[1]
Verwendung
Cycloheptanon wird als Zwischenprodukt zur Herstellung anderer chemischer Verbindungen wie Bencyclan[5] und Pimelinsäure[7] verwendet.
Biologische Bedeutung
Diverse Mikroorganismen, darunter Echinosporangium transversale, Absidia glauca und Mucor plumbeus, sind in der Lage, Cycloheptanon zu Cycloheptanol zu reduzieren.[8][9]
Sicherheitshinweise
Die Dämpfe von Cycloheptanon können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 55 °C) bilden.[1]
Einzelnachweise
- Eintrag zu Cycloheptanon in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. CRC Press, 2009, ISBN 978-1-4200-9084-0.
- Datenblatt Cycloheptanon, 99 % bei Sigma-Aldrich, abgerufen am 29. November 2011 (PDF).
- Thorpe, T. E.; A dictionary of applied chemistry. 1912.
- Siegel, H.; Eggersdorfer, M. (2005), Ketones, Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a15_077
- Hyp J. Dauben, Jr., Howard J. Ringold, Robert H. Wade, David L. Pearson, and Arthur G. Anderson, Jr.: Cycloheptanone In: Organic Syntheses. 34, 1954, S. 19, doi:10.15227/orgsyn.034.0019; Coll. Vol. 4, 1963, S. 221 (PDF).
- Cornils, B.; Lappe, P. (2005): Dicarboxylic Acids, Aliphatic, Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a08_523.pub2
- Lemière, G. L., van De Wal, A. J., Geens, B. C., Pattijn, V. G., Alderweireldt, F. C., Voets, J. P.: Reduction of cycloalkanones by several microorganisms. In: Zeitschrift für allgemeine Mikrobiologie. 15. Jahrgang, Nr. 2, 1975, S. 1521–4028, doi:10.1002/jobm.19750150204.
- José D. Carballeira, Emilio Álvarez, Mercedes Campillo, Leonardo Pardo, José V. Sinisterra: Diplogelasinospora grovesii IMI 171018, a new whole cell biocatalyst for the stereoselective reduction of ketones. In: Tetrahedron: Asymmetry. 15. Jahrgang, Nr. 6, März 2004, S. 951–962, doi:10.1016/j.tetasy.2004.01.034.

