Cyanidin-3-O-galactosid
Cyanidin-3-O-galactosid ist ein Anthocyan aus Galactose und dem Aglycon Cyanidin. Die Grundstruktur ist das Flavylium-Kation. Es ist ein weit verbreiteter Pflanzenfarbstoff, der unter anderem in vielen Arten von Beeren vorkommt.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
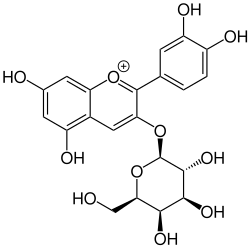 | ||||||||||
| Strukturformel des Kations. Gegenion ist nicht abgebildet | ||||||||||
| Allgemeines | ||||||||||
| Name | Cyanidin-3-O-galactosidchlorid | |||||||||
| Summenformel | C21H21O11Cl | |||||||||
| Kurzbeschreibung |
dunkelbrauner Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 484,8 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Es ist nicht genau bekannt, welche die Gegenionen kationischer Anthocyanine in Pflanzen sind (vermutlich handelt es sich um organische Anionen), isoliert werden sie aber meist als Chloride.[2] Daher sind in der nebenstehenden Infobox Daten zu Cyanidin-3-O-galactosidchlorid angegeben.
Vorkommen
Cyanidin-3-O-galactosid kommt in verschiedenen Früchten vor, darunter Äpfel (Kultur-Apfel und Tee-Apfel) und verschiedene Arten von Beeren.[3] Dazu gehören unter anderem Blaubeeren[3][4], Aronia[3][5], Cranberry, einige Weißdorn-Arten[3] und Preiselbeeren[6], sowie Kornelkirsche[3] und Schwedischer Hartriegel.[7] Es kommt auch in Pistazienschalen[8], im Erdbeerbaum[9], der Japanischen Kamelie[10] und der Erlenblättrigen Felsenbirne vor.[11] Es wurde außerdem in Galläpfeln auf der Kerb-Buche nachgewiesen.[12]
 Roter Apfel
Roter Apfel Blaubeeren
Blaubeeren_-_Killarney%252C_Ontario.jpg.webp) Aronia-Beeren
Aronia-Beeren Kornelkirsche
Kornelkirsche Pistazien
Pistazien Erdbeerbaum
Erdbeerbaum
Biosynthese
Die Biosynthese der Verbindung wurde unter anderem in Apfelschale untersucht.[13] Dabei wird Cyanidin durch eine Galactosyltransferase mit UDP-Galactose glycosyliert.[3][13]
Eigenschaften
Cyanidin-3-O-galactosid ist starkes Antioxidans, wobei sich die Wirkung gegen verschiedene reaktive Sauerstoffspezies stark unterscheidet. Gegen Diphenyl-Pikryl-Hydrazyl, ABTS-Radikale und Superoxid-Ionen zeigt es eine starke Wirkung, nicht jedoch gegen Wasserstoffperoxid.[3][8] Verschiedene Studien deuteten außerdem auf eine Reihe möglicher pharmakologischer Wirkungen hin, darunter Entzündungshemmung und Wirkung gegen Krebszellen (Magen- und Darmkrebs), sowie Wirkung gegen neurodegenerative Erkrankungen.[3][14][15] Die Verbindung ist ein Inhibitor der Sucrase und Maltase.[16]
Einzelnachweise
- Datenblatt Cyanidin-3-galactosidchlorid bei Sigma-Aldrich, abgerufen am 8. August 2023 (PDF).
- Raymond Brouillard: The in vivo expression of anthocyanin colour in plants. In: Phytochemistry. Band 22, Nr. 6, Januar 1983, S. 1311–1323, doi:10.1016/S0031-9422(00)84008-X (elsevier.com [abgerufen am 9. August 2023]).
- Zhongxin Liang, Hongrui Liang, Yizhan Guo, Dong Yang: Cyanidin 3-O-galactoside: A Natural Compound with Multiple Health Benefits. In: International Journal of Molecular Sciences. Band 22, Nr. 5, 24. Februar 2021, S. 2261, doi:10.3390/ijms22052261, PMID 33668383, PMC 7956414 (freier Volltext).
- Hongpeng Yang, Wei Pang, Hao Lu, Daomei Cheng, Xianzhong Yan, Yiyong Cheng, Yugang Jiang: Comparison of Metabolic Profiling of Cyanidin-3- O -galactoside and Extracts from Blueberry in Aged Mice. In: Journal of Agricultural and Food Chemistry. Band 59, Nr. 5, 9. März 2011, S. 2069–2076, doi:10.1021/jf1033619.
- Tunde Jurikova, Jiri Mlcek, Sona Skrovankova, Daniela Sumczynski, Jiri Sochor, Irena Hlavacova, Lukas Snopek, Jana Orsavova: Fruits of Black Chokeberry Aronia melanocarpa in the Prevention of Chronic Diseases. In: Molecules. Band 22, Nr. 6, 7. Juni 2017, S. 944, doi:10.3390/molecules22060944, PMID 28590446, PMC 6152740 (freier Volltext).
- Henna-Maria Lehtonen, Milla Rantala, Jukka-Pekka Suomela, Matti Viitanen, Heikki Kallio: Urinary Excretion of the Main Anthocyanin in Lingonberry (Vaccinium vitis-idaea), Cyanidin 3- O -Galactoside, and Its Metabolites. In: Journal of Agricultural and Food Chemistry. Band 57, Nr. 10, 27. Mai 2009, S. 4447–4451, doi:10.1021/jf900894k.
- Rune Slimestad, Øyvind M Andersen: Cyanidin 3-(2-glucosylgalactoside) and other anthocyanins from fruits of Cornus suecica. In: Phytochemistry. Band 49, Nr. 7, Dezember 1998, S. 2163–2166, doi:10.1016/S0031-9422(98)00397-5.
- Ersilia Bellocco, Davide Barreca, Giuseppina Laganà, Antonella Calderaro, Zineb El Lekhlifi, Salima Chebaibi, Antonella Smeriglio, Domenico Trombetta: Cyanidin-3- O -galactoside in ripe pistachio ( Pistachia vera L. variety Bronte) hulls: Identification and evaluation of its antioxidant and cytoprotective activities. In: Journal of Functional Foods. Band 27, Dezember 2016, S. 376–385, doi:10.1016/j.jff.2016.09.016.
- Maria Miguel, Maria Faleiro, Adriana Guerreiro, Maria Antunes: Arbutus unedo L.: Chemical and Biological Properties. In: Molecules. Band 19, Nr. 10, 30. September 2014, S. 15799–15823, doi:10.3390/molecules191015799, PMID 25271425, PMC 6271735 (freier Volltext).
- Yusuke Sakata, Ken-ichi Arisumi, Ikuo Miyajima: Cyanidin 3-Galactoside, a New Anthocyanin from Camellia japonica subsp. rusticana (Honda) Kitamura and Its Occurrence in the Garden Forms of Camellia of Japanese Origin. In: Journal of the Japanese Society for Horticultural Science. Band 55, Nr. 1, 1986, S. 82–88, doi:10.2503/jjshs.55.82.
- Jocelyn A. Ozga, Asma Saeed, Wendy Wismer, Dennis M. Reinecke: Characterization of Cyanidin- and Quercetin-Derived Flavonoids and Other Phenolics in Mature Saskatoon Fruits ( Amelanchier alnifolia Nutt.). In: Journal of Agricultural and Food Chemistry. Band 55, Nr. 25, 1. Dezember 2007, S. 10414–10424, doi:10.1021/jf072949b.
- Sho Miyazaki, Hironosuke Kurisu, Masaya Nakata, Yoko Saikawa: Identification of a cyanidin-3- O -β-galactoside in gall tissue induced by midges on Japanese beech ( Fagus crenata Blume). In: Bioscience, Biotechnology, and Biochemistry. Band 84, Nr. 4, 2. April 2020, S. 797–799, doi:10.1080/09168451.2019.1698941.
- Yusuke Ban, Satoru Kondo, Benjamin Ewa Ubi, Chikako Honda, Hideo Bessho, Takaya Moriguchi: UDP-sugar biosynthetic pathway: contribution to cyanidin 3-galactoside biosynthesis in apple skin. In: Planta. Band 230, Nr. 5, Oktober 2009, S. 871–881, doi:10.1007/s00425-009-0993-4.
- Haichao Wen, Hehe Tian, Chang Liu, Xiaoxu Zhang, Yao Peng, Xinquan Yang, Feng Chen, Jingming Li: Metformin and cyanidin 3- O -galactoside from Aronia melanocarpa synergistically alleviate cognitive impairment in SAMP8 mice. In: Food & Function. Band 12, Nr. 21, 2021, S. 10994–11008, doi:10.1039/D1FO02122B.
- Zhuoyan Fan, Haichao Wen, Xiaoxu Zhang, Jingming Li, Jiachen Zang: Cyanidin 3- O -β-Galactoside Alleviated Cognitive Impairment in Mice by Regulating Brain Energy Metabolism During Aging. In: Journal of Agricultural and Food Chemistry. Band 70, Nr. 4, 2. Februar 2022, S. 1111–1121, doi:10.1021/acs.jafc.1c06240.
- Sirichai Adisakwattana, Piyawan Charoenlertkul, Sirintorn Yibchok-anun: α-Glucosidase inhibitory activity of cyanidin-3-galactoside and synergistic effect with acarbose. In: Journal of Enzyme Inhibition and Medicinal Chemistry. Band 24, Nr. 1, 1. Februar 2009, S. 65–69, doi:10.1080/14756360801906947.