Cobalt(II)-sulfat
Das Cobalt(II)-sulfat ist im wasserfreien Zustand ein violettstichig-rotes ("pink"), hygroskopisches Salz der Schwefelsäure. Das giftige, krebserzeugende Pulver nimmt an feuchter Luft Hydratwasser auf und bildet das karminrote Cobalt(II)-sulfat-Heptahydrat. Abhängig von der Temperatur treten auch das Hexahydrat und das Monohydrat auf.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
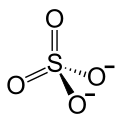 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cobalt(II)-sulfat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel |
| |||||||||||||||
| Kurzbeschreibung |
karminrote Kristalle (Heptahydrat)[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | ||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
gut in Wasser (383 g·l−1 bei 25 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: krebserzeugend, fortpflanzungsgefährdend (CMR)[4] | |||||||||||||||
| MAK |
aufgehoben, da karzinogen[1] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Vorkommen
Cobalt(II)-sulfat tritt selten in Form von einigen Kristallhydrat-Mineralien (Co[SO4]·xH2O) entlang der Oxidationszonen von primären Cobaltmineralien (wie Skutterudit oder Cobaltit) auf. Dies sind: Bieberit (Heptahydrat), Moorhouseit (Hexahydrat), Aplowit (Tetrahydrat) und Cobaltkieserit (Monohydrat).
Das Recycling aus Lithium-Ionen-Akkumulatoren wird erforscht.[7] Dies gewinnt deshalb an Bedeutung, da derartige Akkus in der Elektromobilität eine zunehmende Rolle spielen und Cobalt als Rohstoff darin eine herausragende Rolle spielt.
Gewinnung und Darstellung
Cobalt(II)-sulfat entsteht bei Einwirkung von Schwefelsäure auf elementares Cobalt oder auf Cobaltoxide wie Cobalt(II)-oxid.
Eigenschaften

Wasserfreies Cobalt(II)-sulfat ist polymorph und kristallisiert als orthorhombische A-Form oder monokline B-Form.[8] Das Hepta- und Monohydrat bilden monokline Kristallstrukturen.[2] Das Heptahydrat spaltet bei 41,5 °C Kristallwasser ab und bildet das ebenfalls rote Hexahydrat. Dieses wiederum setzt sich durch Abspaltung von Kristallwasser bei 71 °C zum pinkfarbenen Monohydrat um.
Verwendung
Cobalt(II)-sulfat wird zur Herstellung von Pigmenten, Glasuren, in der Porzellanmalerei, zur Tonung von Papieren (Fotografie), in Bädern für Cobalt-Electroplating und zur Spurenelementsupplementierung in der Aquaristik u. a. verwendet.
Zudem wurde das Salz in den 1960er-Jahren Bier beigemischt, um die Stabilität des Schaumes zu erhöhen.[9] Als Folge kam es in Kanada und den USA zu einer Reihe von Fällen einer Cobalt-induzierten Kardiomyopathie (Cobalt-Kardiomyopathie). In Quebec wurden 49, in Omaha 64 Patienten registriert. Die Symptome umfassten unter anderem Magenschmerzen, Gewichtsverlust, Übelkeit, Atemnot und Husten. Die Letalitätsrate betrug ca. 40 %. Autopsien ergaben schwere Schädigungen an Herzmuskel und Leber. Alle Patienten waren starke Biertrinker (1,5 bis 3 Liter/Tag). Sie konsumierten bevorzugt Sorten von lokalen Brauereien, die etwa einen Monat zuvor angefangen hatten dem Bier Cobalt(II)-sulfat als Schaumstabilisator beizumischen.[9] Die Grenzwerte für Cobalt in Lebensmitteln waren nicht überschritten worden. Das Auftreten der Krankheitsfälle kam unmittelbar zum Stillstand, nachdem die Brauereien die Cobalt(II)-sulfat-Beimischungen einstellten.[10][11]
Einzelnachweise
- Eintrag zu Cobalt(II)-sulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- SLAC: PHYSICAL CONSTANTS OF INORGANIC COMPOUNDS (Memento des vom 5. Dezember 2020 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 391 kB)
- Eintrag zu Cobalt sulphate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 6. Dezember 2019.
- Datenblatt Cobalt(II)-sulfat bei Merck, abgerufen am 19. Januar 2011.
- G.J.A. Speijers, E.I. Krajnc, J.M. Berkvens, M.J. van Logten: Acute oral toxicity of inorganic cobalt compounds in rats. In: Food and Chemical Toxicology. Band 20, Nr. 3, Juni 1982, S. 311–314, doi:10.1016/S0278-6915(82)80298-6.
- Jingu Kang, Gamini Senanayake, Jeongsoo Sohn, Shun Myung Shin: Recovery of cobalt sulfate from spent lithium ion batteries by reductive leaching and solvent extraction with Cyanex 272. In: Hydrometallurgy. Band 100, Nummer 3–4, 2010, S. 168–171. DOI:10.1016/j.hydromet.2009.10.010.
- J.D. Dunitz, P. Pauling: Polymorphism in Anhydrous Cobalt Sulphate. In: Acta Crystallographica. Band 18, Nr. 4, 1965, S. 737–740, doi:10.1107/S0365110X65001688.
- C. Thomas: Spezielle Pathologie. Schattauer Verlag, 1996, ISBN 3-7945-2110-2, S. 179 (eingeschränkte Vorschau in der Google-Buchsuche).
- Expert Group on Vitamins and Minerals. 2002.
- Cardiology: When Beer Brought the Blues. In: New York Times Ausgabe vom 10. Januar 1967.


