Acetylcholin
Acetylcholin (ACh) ist einer der wichtigsten Neurotransmitter in vielen Organismen, so auch im Menschen. Die quartäre Ammoniumverbindung Acetylcholin ist ein Ester der Essigsäure und des einwertigen Aminoalkohols Cholin.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
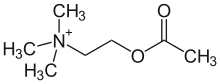 | |||||||||||||
| Gegenion (meist Chlorid) nicht mitgezeichnet | |||||||||||||
| Allgemeines | |||||||||||||
| Freiname | Acetylcholin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C7H16NO2 | ||||||||||||
| Kurzbeschreibung |
weißes, kristallines Pulver oder farblose Kristalle, sehr hygroskopisch (Chlorid)[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Arzneistoffangaben | |||||||||||||
| ATC-Code |
S01EB09 | ||||||||||||
| Wirkstoffklasse | |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | |||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
sehr leicht löslich in Wasser, leicht löslich in Ethanol, schwer löslich in Dichlormethan (Chlorid)[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Geschichte
Otto Loewi wies 1921 an einem Froschherzen nach, dass für die Übertragung eines Nervenimpulses auf das Herz ein chemischer Stoff verantwortlich ist, den er zunächst als Vagusstoff bezeichnete und den Henry H. Dale später als Acetylcholin identifizierte.
Erstmals synthetisch dargestellt wurde der Stoff 1867 von Adolf Baeyer, mit dessen Substanz der Amerikaner Reid Hunt (1870–1948) im Tierversuch Muskelkontraktionen auslösen konnte.[4]
Vorkommen
Acetylcholin findet sich sowohl im zentralen als auch peripheren Nervensystem.
Im vegetativen Nervensystem ist es Transmitter aller präganglionären-autonomen Neuronen. Außerdem vermittelt es die Signalübertragung der postganglionären-parasympathischen Neuronen auf die Endorgane. Die postganglionären-sympathischen Neuronen nutzen normalerweise Noradrenalin, die Bahnen zu den Schweißdrüsen bilden dabei eine Ausnahme, indem sie ebenfalls ACh als Transmitter nutzen.
Im peripheren Nervensystem vermittelt ACh die Erregungsübertragung von den Nerven auf die Muskeln über die neuromuskuläre Endplatte.
Im zentralen Nervensystem findet sich ACh im Corpus striatum, im Nucleus basalis Meynert mit Bahnen zur Großhirnrinde und in der Formatio septalis medialis mit Bahnen zum Hippocampus. Acetylcholin gehört nach γ-Aminobuttersäure (GABA) und Glycin zu den Neurotransmittern, die im Gehirn am häufigsten vorkommen.
Funktion
Zelluläre Funktion
Acetylcholin wirkt an zwei Typen von cholinergen Rezeptoren, dem nicotinischen Acetylcholinrezeptor und dem muskarinischen Acetylcholinrezeptor. Ihren Namen haben sie jeweils aufgrund von Substanzen erhalten, welche sie spezifisch aktivieren, Nicotin beim nikotinischen und Muscarin beim muskarinischen Rezeptor. Von beiden gibt es verschiedene Subtypen.
Der nikotinische ACh-Rezeptor ist ein ligandengesteuerter Ionenkanal, welcher im geöffneten Zustand, das heißt nach ACh-Bindung, für Natrium-, Kalium und Calcium-Ionen durchlässig ist. Es gibt zwei Unterformen des Rezeptors, einen Muskeltyp, welcher selektiv durch Curare gehemmt werden kann und einen Neuronentyp, welcher selektiv durch Hexamethonium hemmbar ist.
Der muskarinische ACh-Rezeptor ist ein G-Protein-gekoppelter Rezeptor mit 5 Untertypen (M1-M5). M1, M3 und M5 sind Gq-gekoppelt, M2 und M4 Gi/Go-gekoppelt.
Es gibt auch Substanzen, die indirekt die Wirkung von ACh an seinen Rezeptoren steigern können (indirekt cholinerg wirkende Substanzen). Dazu gehören die verschiedenen Hemmstoffe der Cholinesterase (eigentlich Acetylcholinesterase-Hemmstoffe). Dies sind ganz unterschiedlich hemmende Stoffe. In die große Gruppe dieser Stoffe gehören die oben erwähnten Medikamente, die man bei der Alzheimer-Erkrankung anwendet. Manche verursachen eine vorübergehende Hemmung, andere blockieren das Enzym dauerhaft. Solche irreversibel wirkenden Hemmstoffe der Cholinesterase sind verschiedene Organophosphorsäureester, z. B. das bekannte Insektizid Parathion (E 605), ebenso aber auch die chemischen Kampfstoffe Sarin, Tabun, Nowitschok und viele andere, die in geringsten Mengen eine tödliche Überstimulierung der cholinergen Synapsen bewirken. Zur Gruppe der reversiblen Cholinesterase-Hemmstoffe zählt der Stoff Neostigmin. Zahlreiche Substanzen blockieren auch die Wirkung von Acetylcholin an seinen Rezeptoren (vor allem an den Muskarinrezeptoren); man nennt dies dann eine anticholinerge Wirkung. Bestimmte Alkaloide wirken anticholinerg, zum Beispiel Atropin bzw. Hyoscyamin oder Scopolamin.
Cholinesterasehemmer wie Parathion oder Neostigmin werden auch als Gegengift für Curare genutzt. Curare blockiert die Andockstellen für Acetylcholin an den motorischen Endplatten und lähmt dadurch die Skelettmuskulatur, was zum Erstickungstod führt. Da die Wirkstoffe von Curare kompetitive Blocker sind, können sie von viel Acetylcholin verdrängt werden. Wenn nun die Acetylcholinesterase blockiert wird, verbleibt mehr Acetylcholin im synaptischen Spalt und die Übertragung funktioniert wieder. Da die Acetylcholin-Konzentration aber auch an den muskarinischen Rezeptoren ansteigt, ist oft eine Nachbehandlung mit Atropin nötig. Dieser Effekt wird auch in der Generalanästhesie genutzt: Vor der Operation wird die Muskulatur mit einem neuromuskulären Blocker (z. B. Rocuronium) gelähmt. Um dessen Wirkung anschließend wieder aufzuheben, wird ein reversibler Cholinesterasehemmer (z. B. Neostigmin) verabreicht. Zusätzlich wird ein Parasympatholytikum (z. B. Atropin) eingesetzt, um die muskarinischen Nebenwirkungen aufzuheben.
Physostigmin (Eserin) ist ebenfalls ein Cholinesterasehemmer und verhindert die Spaltung von Acetylcholin durch die Cholinesterase in Cholin und Acetat.
Biosynthese und Metabolismus

Acetylcholin wird durch das Enzym Cholinacetyltransferase aus Acetyl-CoA und Cholin gebildet.
Das fertige ACh wird aus dem Cytosol, über einen Protonen/Acetylcholin-Antiporter in der Vesikelmembran, in die neurosekretorischen Speichervesikel aufgenommen. In jedem Vesikel sind 5.000 bis 10.000 Acetylcholinmoleküle enthalten. Pro Synapse gibt es etwa eine Million Speichervesikel.
Durch das Enzym Acetylcholinesterase kann es, nach Freisetzung in den synaptischen Spalt und Bindung an den Acetylcholinrezeptor, wieder in Cholin und Essigsäure (beziehungsweise Acetat) gespalten und unwirksam gemacht werden.
Bereitstellung der Ausgangsmoleküle für die Acetylcholinbildung
Cholin kann aus dem synaptischen Spalt über einen Natrium-Cholin-Symporter wieder in die Synapse aufgenommen werden und ist ein Abbauprodukt des zuletzt ausgeschütteten Acetylcholins. Die Verfügbarkeit und Wiederaufnahme von Cholin stellt dabei den geschwindigkeitslimitierenden Schritt für die ACh-Synthese dar, weil es von der Nervenzelle nicht selbst gebildet werden kann.
Pyruvat ist das Endprodukt der Glykolyse im Cytosol jeder Zelle. Das Enzym Pyruvat-Dehydrogenase katalysiert die Umsetzung von Pyruvat zu Acetyl-Coenzym A. Da Acetyl-CoA die innere Mitochondrienmembran nicht passieren kann, wird es in den Citratzyklus eingespeist und durch Reaktion mit Oxalacetat (Katalyse durch Citrat-Synthase) in Citrat umgewandelt. Das Citrat durchquert die Mitochondrienmembran und wird durch die Citrat-Lyase wieder in Acetyl-CoA und Oxalacetat gespalten. Acetyl-CoA steht somit für die Acetylcholinbildung zur Verfügung.
Erkrankungen mit Beteiligung des cholinergen Systems
Bei der Alzheimerschen Krankheit entsteht durch Absterben von hauptsächlich Acetylcholin produzierenden Nervenzellen ein Mangel an Acetylcholin.[8] Diesen Mangel versucht man medikamentös auszugleichen, indem man mit Acetylcholinesterasehemmern dieses Acetylcholin abbauende Enzym hemmt, um dadurch die Acetylcholin-Konzentration an den Synapsen zu erhöhen. Einen anderen Weg geht man über die Verabreichung von Präkursor-Proteinen wie z. B. Deanol und Meclophenoxat, um so den Aufmerksamkeitsgrad zu erhöhen.
Die vermehrte Ansammlung von Acetylcholin durch einen reduzierten Abbau der Substanz verursacht eine cholinerge Krise.
Bei der Muskelschwäche Myasthenia gravis, einer schweren Autoimmunkrankheit, werden Antikörper produziert, welche die Acetylcholinrezeptoren in Muskelzellen zerstören und damit die Muskeltätigkeit schwächen. Das kann so weit gehen, dass die Patienten die Augen nicht mehr offen halten können.[9]
Acetylcholin in Tier- und Pflanzengiften
Der Anteil an Acetylcholin beträgt im Gift der Hornisse (Vespa crabro) etwa sechs Prozent des Trockengewichts und liegt damit in der höchsten Konzentration vor, die bisher bei einem Lebewesen gefunden wurde. Der Stich der Hornisse wird aufgrund dieser hohen Konzentration als besonders schmerzhaft empfunden. Dabei ist der Stich nicht giftiger als bei anderen Wespen oder bei Bienen (Bienengift), deren Gift jedoch kein Acetylcholin enthält. Auch im Gift der Brennnesseln sowie der Feuerfische und anderer Skorpionfische ist Acetylcholin für die schmerzhafte Wirkung verantwortlich.
Verwendung
In der Augenheilkunde wird Acetylcholin zur Verengung und Reposition der präoperativ erweiterten Pupille nach Extraktion der Linse bei Kataraktoperationen, Iridektomie, perforierender Keratoplastik und anderen Eingriffen am vorderen Augenabschnitt verwendet, wenn hierfür eine sehr schnelle und komplette Miosis notwendig ist.
Acetylcholin darf laut EG-Kosmetikrichtlinie nicht als Bestandteil in kosmetischen Mitteln enthalten sein.
Siehe auch
Einzelnachweise
- Eintrag Acetylcholine Chloride CRS beim Europäisches Direktorat für die Qualität von Arzneimitteln (EDQM), abgerufen am 24. Januar 2009.
- Eintrag zu Acetylcholine chloride bei Thermo Fisher Scientific, abgerufen am 13. Oktober 2023.
- Datenblatt Acetylcholine chloride bei Sigma-Aldrich, abgerufen am 2. März 2019 (PDF).
- Otto Westphal, Theodor Wieland, Heinrich Huebschmann: Lebensregler. Von Hormonen, Vitaminen, Fermenten und anderen Wirkstoffen. Societäts-Verlag, Frankfurt am Main 1941 (= Frankfurter Bücher. Forschung und Leben. Band 1), S. 33 f. und 81 f.
- Barbara E. Jones: From waking to sleeping: neuronal and chemical substrates. In: Trends in Pharmacological Sciences. Band 26, Nr. 11, November 2005, S. 578–586, doi:10.1016/j.tips.2005.09.009, PMID 16183137.
- A. M. Himmelheber, M. Sarter, J. P. Bruno: Increases in cortical acetylcholine release during sustained attention performance in rats. In: Brain Research. Cognitive Brain Research. Band 9, Nr. 3, 2000, S. 313–325, PMID 10808142.
- R. M. Ridley, P. M. Bowes, H. F. Baker, T. J. Crow: An involvement of acetylcholine in object discrimination learning and memory in the marmoset. In: Neuropsychologia. Band 22, Nr. 3, 1984, S. 253–263, PMID 6431311.
- P. T. Francis, A. M. Palmer, M. Snape, G. K. Wilcock: The cholinergic hypothesis of Alzheimer's disease: a review of progress. In: Journal of Neurology, Neurosurgery, and Psychiatry. Band 66, Nr. 2, 1999, S. 137–147, PMID 10071091, PMC 1736202 (freier Volltext).
- Eric Kandel: Auf der Suche nach dem Gedächtnis, 2009 3. Auflage, Goldmann, München