Cholesterinbiosynthese
Die Cholesterinbiosynthese ist der Stoffwechselweg, der Eukaryoten dazu befähigt, Cholesterin aus einfachen Ausgangsstoffen herzustellen. Cholesterin hat eine überragende Bedeutung als Bestandteil der Zellmembran, als Speicherlipid und als Basis für die Synthese weiterer wichtiger Stoffe.

Ausgangspunkt der Cholesterinsynthese ist Dimethylallylpyrophosphat (DMAPP), das im Mevalonatweg entsteht. Die Biosynthese von Cholesterin aus DMAPP erfolgt über 18 Zwischenstufen.
Beim Menschen sind die Leber und die Darmschleimhaut die Hauptorte der Cholesterinsynthese. Im menschlichen Organismus sind viele Zellen in der Lage, Cholesterin zu synthetisieren. Mengenmäßig am meisten wird jedoch von der Leber produziert. Das Gehirn synthetisiert das von ihm benötigte Cholesterin vollständig selbst, da dieses die Blut-Hirn-Schranke nicht passieren kann.
Reaktionsschritte
Die Biosynthese des Cholesterins geht von den Endprodukten des Mevalonatbiosyntheseweges, von Dimethylallylpyrophosphat und von Isopentenylpyrophosphat aus.
GPP und Farnesylpyrophosphat
![]() +
+ ![]()
![]() + PPi
+ PPi
![]() +
+ ![]()
![]() + PPi
+ PPi
DMAPP und IPP werden durch eine Kopf-zu-Schwanz-Kondensation durch die GGPP-Synthase zu Geranylpyrophosphat (GPP) verknüpft, das gleiche Enzym verknüpft anschließend durch eine weitere Kopf-zu-Schwanz-Kondensation ein weiteres IPP mit dem GPP zu Farnesylpyrophosphat (FPP).
Squalen
2![]()
 + PPi
+ PPi
 + 2 NADPH/H+
+ 2 NADPH/H+  + 2 NADP+ + PPi
+ 2 NADP+ + PPi
Zwei FPP werden in einer Schwanz-zu-Schwanz-Kondensation über die Zwischenverbindung Praesqualenpyrophosphat mithilfe der Squalensynthase zu Squalen verknüpft.
Epoxysqualen
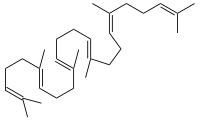 + AH2 + O2
+ AH2 + O2 -Squalen-2%252C3-epoxid.svg.png.webp) + A + H2O
+ A + H2O
Squalen reagiert durch die Squalen-Monooxygenase zu (S)-2,3-Epoxysqualen.
Lanosterin
-Squalen-2%252C3-epoxid.svg.png.webp)

Epoxysqualen zyklisiert mithilfe der Lanosterin-Synthase, über ein Protosterol-Kation, zu Lanosterin.
Lanosterin wird über verschiedene Zwischenverbindungen zu Cholesterin umgewandelt, dieser gesamte enzymatische Prozess ist in der Membran des Endoplasmatischen Retikulums lokalisiert.
4,4-Dimethyl-5α-cholesta-8,14,24-trien-3β-ol
Das Enzym Lanosterin-Demethylase katalysiert die dehydrierende Demethylierung von Lanosterin zum 4,4-Dimethyl-5α-cholesta-8,14,24-trien-3β-ol.
 + 3 O2 + 3 NADPH
+ 3 O2 + 3 NADPH  + Formiat + 4 H2O + 3 NADP+
+ Formiat + 4 H2O + 3 NADP+
In mehreren Oxidationsschritten wird die 14-Methylgruppe des Lanosterins entfernt und eine 14,15-Doppelbindung erzeugt, wobei Formiat abgespalten wird.
14-Demethyllanosterin
 + NADPH/H+
+ NADPH/H+  + NADP+
+ NADP+
4,4-Dimethyl-5α-cholesta-8,14,24-trien-3β-ol wird mittels Sterol-Delta14-Reduktase hydriert, es entsteht 14-Demethyllanosterin.
4α-Methylzymosterin-4-carboxylat oder Zymosterincarboxylat
Die Oxidation der 4-Methylgruppe am 14-Demethyllanosterin oder am 4α-Methyl-Zymosterin wird durch die 4-Methylsterol-Monooxygenase katalysiert. Resultat sind 4α-Methyl-Zymosterin-4-carboxylat oder Zymosterincarboxylat.
4-Methylzymosteron oder Zymosteron
 + NADP+
+ NADP+  + CO2 + NADPH/H+
+ CO2 + NADPH/H+
4alpha-Methylzymosterin-4-carboxylat wird mithilfe Sterol-4alpha-carboxylat-3-Dehydrogenase zu 3-Keto-4-methylzymosterin umgesetzt. Alternativ akzeptiert das Enzym als Substrat Zymosterincarboxylat; dabei entsteht Zymosteron.
4α-Methylzymosterin oder Zymosterin
Das Enzym 3-Ketosteroid-Reduktase (HSD17B7) reduziert Zymosteron zu Zymosterin. Alternativ ist es in der Lage, 4α-Methylzymosteron zu 4α-Methylzymosterin zu reduzieren.
 + NADPH/H+
+ NADPH/H+ 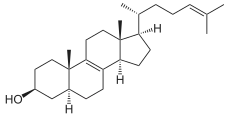 + NADP+
+ NADP+
Zymosteron wird zu Zymosterin hydriert.
5α-Cholesta-7,24-dien-3β-ol

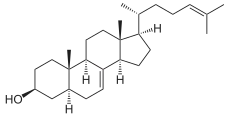
Zymosterin wird zu 5α-Cholesta-7,24-dien-3β-ol umgelagert, katalysiert von der Sterol-Delta8/7-Isomerase.
Lathosterol
 + NADPH/H+
+ NADPH/H+ 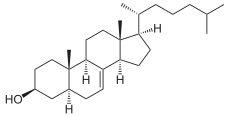 + NADP+
+ NADP+
5α-Cholesta-7,24-dien-3β-ol wird mittels Sterol-Delta24-Reduktase zu Lathosterol hydriert.
7-Dehydrocholesterin oder Desmosterin
 + O2 + NADPH/H+
+ O2 + NADPH/H+ 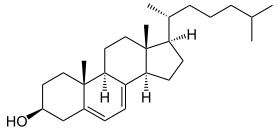 + 2 H2O + NADP+
+ 2 H2O + NADP+
Lathosterol wird zu 7-Dehydrocholesterin dehydriert, mithilfe der Lathosterol-Oxidase.
Alternativ wird 5α-Cholesta-7,24-dien-3β-ol mittels der 7-Dehydrocholesterol-Reduktase zu Desmosterin hydriert.
Cholesterin
 + NADH/H+
+ NADH/H+ 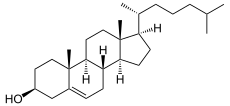 + NAD+
+ NAD+
7-Dehydrocholesterin wird zu Cholesterin hydriert. Katalysator ist die 7-Dehydrocholesterol-Reduktase.
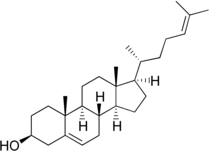 + NADPH/H+
+ NADPH/H+  + NADP+
+ NADP+
Desmosterin wird zu Cholesterin hydriert, katalysiert von der Sterol-Delta24-Reduktase.
Geschichte
Konrad Bloch und Feodor Lynen teilten sich 1964 den Nobelpreis für Physiologie/Medizin für die Entdeckung des Cholesterin- und Fettsäuren-Metabolismus und seiner Regulation.[1] Weitere wichtige Beiträge zur Aufklärung der Biosynthese des Cholesterins leisteten George Joseph Popják und John W. Cornforth.
Weblinks
- D’Eustachio / reactome: Cholesterol biosynthesis
Einzelnachweise
- Informationen der Nobelstiftung zur Preisverleihung 1964 an Konrad Bloch und Feodor Lynen (englisch).