Chlortrifluormethan
Chlortrifluormethan ist eine chemische Verbindung aus der Gruppe der aliphatischen, gesättigten Halogenkohlenwasserstoffe (FCKW).
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
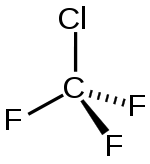 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Chlortrifluormethan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | CClF3 | ||||||||||||||||||
| Kurzbeschreibung |
farbloses, geruchloses, in höheren Konzentrationen süßlich riechendes Gas[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 104,46 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
−81,4 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Treibhauspotential |
15451 (bezogen auf 100 Jahre)[5] | ||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−706,3 kJ/mol[6] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Chlortrifluormethan kann durch Reaktion von Methan mit Chlor und Fluorwasserstoff mit Aluminiumchlorid als Katalysator gewonnen werden.[7]
Eigenschaften
Chlortrifluormethan ist ein farbloses, geruchloses, in höheren Konzentrationen ähnlich wie Tetrachlormethan süßlich riechendes Gas. Ab 150 °C zersetzt sich die Verbindung. Es besitzt eine kritische Temperatur von 28,78 °C, einen kritischen Druck von 38,6 bar, eine kritische Dichte von 0,581 kg/l und eine Tripelpunkt-Temperatur von −189 °C.[1]
Verwendung
Chlortrifluormethan wurde früher unter dem Namen R 13 oder Freon 13 als Kältemittel eingesetzt. Aufgrund seines Treibhauspotenzial von 14.000 und seines Ozonabbaupotenzial von 1 wurde im Montreal-Protokoll die weitere Produktion in Zukunft verboten.
Einzelnachweise
- Eintrag zu Chlortrifluormethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- William M. Haynes: CRC Handbook of Chemistry and Physics, 93rd Edition. CRC Press, 2016, ISBN 978-1-4398-8050-0, S. 120 (eingeschränkte Vorschau in der Google-Buchsuche).
- Honeywell: R 13 (PDF; 26 kB)
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 75-72-9 bzw. Chlortrifluormethan), abgerufen am 2. November 2015.
- G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (ipcc.ch [PDF]).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-19.
- c-f-c.com: Chlorotrifluoromethane (Memento des vom 18. September 2010 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis..

