Chlortoluole
Die Chlortoluole bilden in der Chemie eine Stoffgruppe, die sich sowohl vom Toluol als auch vom Chlorbenzol ableitet. Die Struktur besteht aus einem Benzolring mit angefügter Methylgruppe (–CH3) und Chlor (–Cl) als Substituenten. Durch deren unterschiedliche Anordnung ergeben sich drei Konstitutionsisomere mit der Summenformel C7H7Cl. Das an der Methylgruppe chlorierte Isomer bezeichnet man als Benzylchlorid.
| Chlortoluole | ||||||
| Name | 2-Chlortoluol | 3-Chlortoluol | 4-Chlortoluol | |||
| Andere Namen | 2-Chlortoluen, o-Chlortoluol, 1-Chlor-2-methylbenzol |
3-Chlortoluen, m-Chlortoluol, 1-Chlor-3-methylbenzol |
4-Chlortoluen, p-Chlortoluol, 1-Chlor-4-methylbenzol | |||
| Strukturformel | 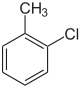 |
 |
 | |||
| CAS-Nummer | 95-49-8 | 108-41-8 | 106-43-4 | |||
| 25168-05-2 (Isomerengemisch)[1] | ||||||
| PubChem | 7238 | 7931 | 7810 | |||
| ECHA-InfoCard | 100.002.205 | 100.003.255 | 100.003.089 | |||
| 100.042.438 (100.137.417) (Isomerengemisch) | ||||||
| Summenformel | C7H7Cl | |||||
| Molare Masse | 126,59 g·mol−1 | |||||
| Aggregatzustand | flüssig | |||||
| Kurzbeschreibung | farblose Flüssigkeit mit aromatischem Geruch |
farblose Flüssigkeit | ||||
| Schmelzpunkt | −35 °C[2] | −48 °C[3] | 7,5 °C[4] | |||
| Siedepunkt | 159 °C[2] | 162 °C[3] | 162 °C[4] | |||
| Dichte | 1,08 g·cm−3 (20 °C)[2] | 1,08 g·cm−3 (20 °C)[3] | 1,07 g·cm−3 (20 °C)[4] | |||
| Dampfdruck | 3,82 hPa (20 °C)[2] | 3,8 hPa (20 °C)[3] | 3,6 hPa (20 °C)[4] | |||
| Löslichkeit in Wasser |
50 mg·l−1 (20 °C)[2] | 0,106 g·l−1 (25 °C)[3] | 0,11 g·l−1 (25 °C)[4] | |||
| Flammpunkt | 43 °C[2] | 48 °C[3] | 59 °C[4] | |||
| Zündtemperatur | >550 °C[2] | >550 °C[3] | 570 °C[4] | |||
| Explosionsgrenzen | 1,3 bis 8,3 %[2][3][4] | |||||
| GHS- Kennzeichnung |
aus Verordnung (EG) Nr. 1272/2008 (CLP),[5] ggf. erweitert
| |||||
| H- und P-Sätze | 226‐332‐361d‐410[2] | 226‐332‐411[3] | 226‐317‐332‐411[4] | |||
| keine EUH-Sätze | ||||||
| 273‐210‐280 304+340‐310[2] |
210‐273[3] | 273‐280[4] | ||||
| Tox-Daten | 3900 mg·kg−1 (LD50, Ratte, oral)[2] | 2100 mg·kg−1 (LD50, Ratte, oral)[4] | ||||
Eigenschaften
Die Chlortoluole sind in Wasser praktisch nicht löslich; sie sind jedoch mit anderen organischen Lösungsmitteln, wie z. B. Benzol, Alkohol, Ether, Ethylacetat und Chloroform, beliebig mischbar. Die Siedepunkte der drei Isomere liegen nah beieinander, während ihre Schmelzpunkte sich deutlich unterscheiden. Das 4-Chlortoluol, das die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt.
| Dampf-Flüssig-Gleichgewichte | ||||
|---|---|---|---|---|
| Name | 2-Chlortoluol | 3-Chlortoluol | 4-Chlortoluol | |
| Dampfdruckfunktion nach Antoine | Parameter nach log10(P) = A−(B/(T+C)) (P in bar, T in K) | |||
| A | 4,48741 | 4,48148 | 4,47458 | |
| B | 1768,105 | 1807,576 | 1795,293 | |
| C | −38,389 | −32,105 | −34,380 | |
| Temperaturbereich | 278,4 K – 432,5 K | 277,9 K – 435,5 K | 278,7 K – 435,5 K | |
| Quelle | [6] | |||
Darstellung
Die Chlortoluole lassen sich aus den Toluidinen mittels der Sandmeyer-Reaktion darstellen.[7] Ein Gemisch von 2- und 4-Chlortoluol erhält man durch Chlorierung von Toluol mit Chlor und Eisen, wobei sich Eisen(III)-chlorid als Lewis-Säure bildet.
Verwendung
Chlortoluole werden als Lösungsmittel und als Zwischenprodukt bei der Herstellung von Farbstoffen, Pflanzenschutzmitteln und Arzneistoffen verwendet.
Hinweis
Chlortoluole mit mehr als einem Chloratom werden als polychlorierte Toluole bezeichnet.
Sicherheitshinweise
Chlortoluole können Kunststoffe zersetzen und Metalle schwach korrodieren. Bei der thermischen Zersetzung von Chlortoluolen bildet sich giftiger und ätzender Chlorwasserstoff.
Einzelnachweise
- Eintrag zu Chlortoluol, Isomere in der GESTIS-Stoffdatenbank des IFA, abgerufen am 26. Dezember 2019. (JavaScript erforderlich)
- Eintrag zu 2-Chlortoluol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 26. Dezember 2019. (JavaScript erforderlich)
- Eintrag zu 3-Chlortoluol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 26. Dezember 2019. (JavaScript erforderlich)
- Eintrag zu 4-Chlortoluol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 26. Dezember 2019. (JavaScript erforderlich)
- Eintrag zu Chlorotoluene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 11. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Stull, D.R.: Vapor Pressure of Pure Substances. Organic and Inorganic Compounds in Ind. Eng. Chem. 39 (1947) 517–540, doi:10.1021/ie50448a022.
- Autorengemeinschaft: Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 566.


