Chlorierung
Chlorierung – auch Chlorieren – ist in der Chemie eine Form der Halogenierung. Dabei wird das Element Chlor in eine organisch-chemische Verbindung eingeführt. Zur Einführung von Chlor in eine chemische Verbindung werden anorganische oder niedermolekulare organische Chlorierungsmittel benutzt. Von den Chlorierungsmitteln ist molekulares Chlor das am häufigsten angewandte. Je nach Prozessführung unterscheidet man die thermische, die katalytische oder die photochemische Chlorierung.
Chlorierungsreaktionen
Die Einführung von Chlor erfolgt über Additions- oder Substitutionsreaktionen. Oft fördert die Anwesenheit typischer Halogenüberträger wie Eisen oder Iod die Chlorierung.[1] Technische Bedeutung hat die Photochlorierung. Dabei wird ein Alkan in einer Radikalreaktion in Chloralkane überführt.[2]
Additionsreaktionen
Monochlorierte Alkane erhält man durch die Additionsreaktion von Chlorwasserstoff (HCl) an Alkene. Analog entsteht aus Cyclohexen durch Chlorwasserstoff-Addition an die C=C-Doppelbindung Chlorcyclohexan:

1,2-Dichlorierte Alkane entstehen durch die Addition von Chlor (Cl2) an Alkene, z. B. Cyclohexen;
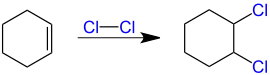
Die Addition von Chlor (Cl2) an Alkine liefert analog zunächst trans-1,2-dichlorierte Alkene. Durch Anlagerung eines weiteren Chlormoleküls entstehen 1,1,2,2-Tetrachloralkane.[3]
Substitutionsreaktionen
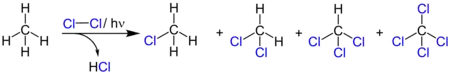
Die Photochlorierung von Methan liefert als Gemisch von Chlorierungsprodukten Monochlormethan, Dichlormethan (Methylenchlorid), Trichlormethan (Chloroform) und Tetrachlormethan; Schematische Darstellung ohne Berücksichtigung der Stöchiometrie:
Alkylierte Aromaten (z. B. Toluol) kann man gezielt in der Seitenkette (SSS-Regel) oder am aromatischen Kern (KKK-Regel) chlorieren.[4][5] – In Allylstellung kann man Alkene mit N-Chlorsuccinimid chlorieren. Durch Einwirkung von Phosphorchloriden oder Thionylchlorid auf Alkohole kann man Chloralkane herstellen, wobei die Hydroxygruppe durch ein Chloratom substituiert wird.[5]
Chlorierungsmittel
Anorganische Chlorierungsmittel (Auswahl)
Organische Chlorierungsmittel (Auswahl)
Einzelnachweise
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 1: A–Cl. 8. neubearbeitete und erweiterte Auflage. Franckh’sche Verlagshandlung, Stuttgart 1979, ISBN 3-440-04511-0, S. 720–721, 732–733.
- Hans Peter Latscha, Uli Kazmaier, Helmut Alfons Klein: Organische Chemie: Chemie-Basiswissen II. Springer DE, 2008, ISBN 3-540-77107-7, S. 56 (eingeschränkte Vorschau in der Google-Buchsuche).
- Siegfried Hauptmann: Organische Chemie. 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 260, ISBN 3-342-00280-8.
- Ulrich Lüning: Organische Reaktionen. 2. Auflage, Elsevier GmbH, München, 2007, S. 89, ISBN 978-3-8274-1834-0.
- Siegfried Hauptmann: Organische Chemie. 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 297, ISBN 3-342-00280-8.