Cetirizin
Cetirizin ist ein Arzneistoff aus der Gruppe der Antihistaminika der 2. Generation, der zur Linderung von Beschwerden allergischer Erkrankungen eingesetzt wird. Die Substanz ist ausgehend von Hydroxyzin, einem Antihistaminikum der ersten Generation, entwickelt worden. Chemisch leitet sich Cetirizin vom Diphenylmethan ab und zählt zu den Derivaten des Piperazins.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
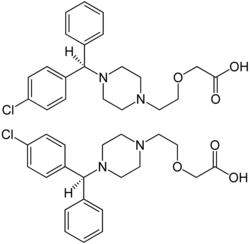 | ||||||||||||||||||||||
| 1:1-Gemisch aus (R)-(−)-Cetirizin (oben) und (S)-(+)-Cetirizin (unten), siehe Stereochemie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Cetirizin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel |
| |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
R06AE07 | |||||||||||||||||||||
| Wirkstoffklasse |
Antihistaminika des Ethylendiamin-Typs | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Anwendung
Cetirizin wird zur Linderung der Beschwerden bei Allergien, Neurodermitis, Nesselsucht und Juckreiz und anderen allergischen Hautreaktionen eingesetzt. Ferner kann Cetirizin bei Heuschnupfen und allergisch bedingter Bindehautentzündung eingenommen werden. Unter den neueren H1-Antihistaminika gehört Cetirizin neben Loratadin zu den am häufigsten oral eingesetzten Antiallergika.
Bei Hauskatzen mit atopischer Dermatitis zeigt Cetirizin keine juckreizstillende Wirkung.[3]
Wirkungsmechanismus
Die Wirkung von Histamin am H1-Rezeptor wird unterbrochen. Histamin verursacht die typischen Heuschnupfensymptome wie tränende Augen und verstopfte Nase, aber auch Jucken der Haut. Die Antihistaminika der zweiten Generation haben den Vorteil, dass nur sehr wenig Wirkstoff in das zentrale Nervensystem gelangt, da das Arzneistoffmolekül unter physiologischen Bedingungen als Zwitterion vorliegt und die Blut-Hirn-Schranke so gut wie nicht überwunden werden kann. Im Vergleich zu Antihistaminika der ersten Generation treten sedierende Nebenwirkungen wie z. B. Müdigkeit seltener auf.
Maximale Plasmakonzentrationen werden 0,5 bis 1,5 Stunden nach oraler Gabe erreicht. Die Plasmahalbwertszeit liegt bei ungefähr 9 bzw. 10 Stunden. Die Ausscheidung erfolgt zu 65 % über die Nieren, hauptsächlich in unveränderter Form. Cetirizin hat über den Bereich von 5 bis 60 mg eine lineare Kinetik.[4][5]
Nebenwirkungen
Zum Teil (ca. 1 von 100 Behandelten) wird über Müdigkeit, Kopfschmerzen, Halluzinationen, Benommenheit oder Mundtrockenheit berichtet.
Außerdem steht Cetirizin wie Loratadin und Azelastin im Verdacht bei bestimmter Veranlagung unter Umständen Herzrhythmusstörungen auszulösen[6] – allerdings nicht so häufig wie Terfenadin, wo diese Nebenwirkung bekannt und nachgewiesen ist.[7]
Wechselwirkungen
Bei therapeutischen Dosierungen von Cetirizin wurden im Zusammenhang mit der Einnahme von Alkohol – bei einer Plasmakonzentration von 0,5 Gramm/Liter (0,5 „Promille“) – keine klinisch signifikanten Arzneimittelwechselwirkungen festgestellt.
Aufgrund der Pharmakokinetik, Pharmakodynamik und des Verträglichkeitsprofils von Cetirizin sind keine Wechselwirkungen mit diesem Antihistaminikum zu erwarten. Tatsächlich wurden weder pharmakodynamische noch signifikante pharmakokinetische Wechselwirkungen in durchgeführten Interaktionsstudien berichtet, insbesondere nicht mit Pseudoephedrin und Theophyllin (400 mg/Tag). Das Ausmaß der Resorption von Cetirizin wird durch Nahrungsaufnahme nicht vermindert, obwohl die Resorptionsgeschwindigkeit herabgesetzt ist.[8]
Stereochemie
Cetirizin ist ein 1:1-Gemisch (Racemat) aus dem (R)-(−)-Enantiomer und (S)-(+)-Enantiomer. Durch eine Racematspaltung lässt sich gezielt das aktive (R)-(−)-Enantiomer (Eutomer) von Cetirizin gewinnen, das als Levocetirizin bezeichnet wird. Der Bedeutung der Enantiomerenreinheit der synthetisch hergestellten Wirkstoffe wurde durch die Entwicklung von Levocetirizin Beachtung eingeräumt, denn die beiden Enantiomere eines chiralen Arzneistoffes zeigen fast immer eine unterschiedliche Pharmakologie und Pharmakokinetik. Das wurde früher aus Unkenntnis über stereochemische Zusammenhänge oft ignoriert.[9]
Eine Überlegenheit gegenüber dem racemischen Cetirizin hinsichtlich der Wirksamkeit lässt sich jedoch für Levocetirizin aufgrund des Fehlens von Vergleichsstudien bislang nicht eindeutig belegen,[10] auch wenn einzelne Untersuchungen darauf hindeuten.[11]
Synthese
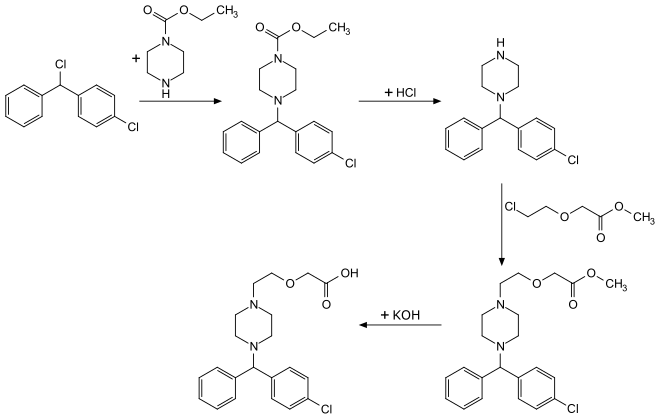
Cetirizin kann in einer vierstufigen Synthese hergestellt werden. Im ersten Schritt wird 4-Chlorbenzhydrylchlorid mit einem einseitig mit einer Carbethoxygruppe geschützten Piperazin umgesetzt. Die Abspaltung der Carbamat-Schutzgruppe wird dann mittels Salzsäure erreicht. Danach erfolgt eine N-Alkylierung mit Methyl-2‐(2‐chloroethoxy)acetat. Eine anschließende Esterverseifung mittels Kalilauge ergibt die Zielverbindung. Aus der Synthesesequenz resultiert das Racemat.[12]
Handelsnamen
Monopräparate
Cerchio (IT), Cerzin (CH), Cetallerg (CH), Cet eco (CH), Ceterifug (D), Cetiderm (D), CetiLich (D), Ceti-Puren (D), Cetirigamma (D), Cetrin (CH), Cetryn (TR), Helvecin (CH), Hista-X (CH), RatioAllerg (A), Reactine (D), Tirizin (A), Triofan Allergie (CH), Zyrtec (D, A, CH), zahlreiche Generika (D)
Kombinationspräparate
Reactine duo (D)
Einzelnachweise
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 334, ISBN 978-0-911910-00-1.
- Datenblatt Cetirizin dihydrochloride bei Sigma-Aldrich, abgerufen am 16. März 2011 (PDF).
- K. Wildermuth, S. Zabel, R. A. Rosychuk: The efficacy of cetirizine hydrochloride on the pruritus of cats with atopic dermatitis: a randomized, double-blind, placebo-controlled, crossover study. In: Veterinary dermatology. Band 24, Nummer 6, Dezember 2013, S. 576–81, e137, doi:10.1111/vde.12067, PMID 24112588.
- Fachinformation Reactine duo 5 mg / 120 mg Retardtabletten. Johnson & Johnson, Stand Dezember 2018.
- Fachinformation zu Cetirizin Actavis® 10 mg. (Memento des vom 25. November 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. ODDB.org; abgerufen am 21. Juni 2013.
- S. Haffner et al.: Unerwünschte Arzneimittelwirkungen: QT-Verlängerungen und Torsade-de-Pointes-Arrhythmien. In: Deutsche Medizinische Wochenschrift, 2002, Band 127, S. 1022–1024. doi:10.1055/s-2002-28319.
- RL Woosley, Y Chen, JP Freiman, RA. Gillis: Mechanism of the cardiotoxic actions of terfenadine. In: J Am Med Ass., 1993, 269, S. 1532–1536, PMID 8445816.
- Zyrtec: Zusammenfassung der Merkmale des Arzneimittels, Stand: 8. Oktober 2008 (PDF; 323 kB) auf der Website der Europäischen Arzneimittelagentur EMEA; abgerufen am 18. August 2009.
- E. J. Ariëns: Stereochemistry, a basis for sophisticated nonsense in pharmacokinetics and clinical pharmacology. In: European Journal of Clinical Pharmacology, 1984, Band 26, S. 663–668, doi:10.1007/BF00541922.
- G.M. Walsh: A review of the role of levocetirizine as an effective therapy for allergic disease. In: Expert Opin Pharmacother, 2008, Band 9, S. 859–867, PMID 18345961.
- C. Bachert: Levocetirizin vs. Cetirizin: Eine evidenzbasierte Differenzierung anhand der Pharmakologie und Klinik. In: Allergologie, 2006, Band 29, S. 268–273.
- A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances - Synthesis, Patents, Applications, 4. Auflage (2001) Thieme-Verlag Stuttgart, ISBN 978-1-58890-031-9.