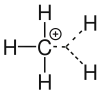
Carbeniumion
Als Carbeniumion wird in der Organischen Chemie ein Kohlenwasserstoff-Molekül bezeichnet, das ein positiv geladenes Kohlenstoffatom besitzt.[1] Carbeniumion ist ein Unterbegriff zu Carbokation. Ein Carbeniumion ist ein dreibindiger Kohlenstoff, der ein Elektronensextett und ein freies p-Orbital besitzt.[2] Ein negativ geladenes Kohlenstoffatom als Bestandteil eines organischen Moleküls wird Carbanion genannt.
Nach der Anzahl der organischen Reste werden primäre (+CH2R), sekundäre (+CHR2) und tertiäre Carbeniumionen (+CR3) unterschieden. Die Stabilität der Carbeniumionen nimmt in dieser Reihenfolge zu. Ist der Rest R eine Vinylgruppe oder ein Arylrest (z. B. Phenylrest), ist das Carbeniumion mesomeriestabilisiert. Besonders stabil ist das Triphenylcarbeniumion. Für die Einschätzung der relativen Stabilität verschiedener Carbeniumionen sind die mesomeren Einflüsse (M-Effekt) wichtiger als die induktiven Effekte (I-Effekte) und die Hyperkonjugation. Ist keine Mesomeriestabilisierung möglich, nimmt die Stabilität der Carbeniumionen durch den I-Effekt mit der Anzahl der Reste R von primär zu tertiär zu.
Carbeniumionen treten häufig als reaktive Zwischenstufen bei chemischen Reaktionen in der Organischen Chemie auf, so zum Beispiel bei der nukleophilen Substitution 1. Ordnung (SN1-Reaktion). Carbeniumionen können in Konkurrenz zu Bromoniumionen auch bei der Bromaddition an die C=C-Doppelbindung von Alkenen auftreten:

Sie können mit Supersäuren, wie Antimonpentafluorid (SbF5), erzeugt werden. Bei der Umsetzung von tert-Butylfluorid mit Antimonpentafluorid kommt es zu einer heterolytischen Spaltung der C-F-Bindung unter Bildung des tert-Butylkations und des Anions SbF6−. Beide Ionen können ein stabiles Salz bilden, das bei tiefen Temperaturen lange haltbar ist. Tertiäre Alkylcarbeniumionen lassen sich auch über die Abspaltung eines Hydridions aus dem entsprechenden Kohlenwasserstoff mithilfe einer starken Protonensäure, wie beispielsweise einer Mischung aus Antimonpentafluorid und Fluorsulfonsäure, herstellen.
Literatur
- Armin de Meijere: Neues über Carbokationen, Chemie in unserer Zeit, 9. Jahrg. 1975, Nr. 2, S. 35–42, ISSN 0009-2851
Einzelnachweise
- Vollhardt, C. et al: Organische Chemie, Wiley-VCH-Verlag, 4. Auflage, Weinheim 2005, Seite 284.
- Eintrag zu carbenium ion. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.C00812 – Version: 2.1.5.
- Joachim Buddrus: Grundlagen der Organischen Chemie, 4. Auflage, de Gruyter Verlag, Berlin, 2011, S. 166–167, ISBN 978-3-11-024894-4.