Calicheamicine
Calicheamicine sind eine Gruppe von strukturell sehr eng verwandten, hochgradig toxischen Zellgiften. Sie wirken 1000-mal stärker als Doxorubicin. Diese Bakterientoxine werden durch das Bakterium Micromonospora echinospora gebildet.[2] Die Einnahme von wenigen Gramm führt unweigerlich zum Tod, Gegenmittel sind nicht bekannt. Der Hauptvertreter Calicheamicin γ1 wird – gekoppelt an einen Antikörper – in der gezielten Krebstherapie eingesetzt.[3]
Eigenschaften
Der aus Micromonospora echinospora ssp. calichensis isolierte Calicheamicin-Komplex enthält eine Reihe von 15 bis 20 Verbindungen mit eng verwandten chemischen Strukturen, die nach ihrer relativen TLC-Mobilität mit griechischen Buchstaben benannt wurden.[4] Sie sind strukturell, in ihrer biologischen Wirkung und auch ihrem Wirkmechanismus den Esperamicinen sehr ähnlich und enthalten neben dem Endiin eine Allyltrisulfideinheit und die am Brückenkopf sitzende Enonfunktion. Ihre Strukturen wurden von Lee et al. aufgeklärt und 1987, 1989 und 1992 veröffentlicht.[5][6][7][4] Der bekannteste Vertreter ist das iodhaltige Calicheamicin γ1I (Calicheamicin γ1(I), auch nur Calicheamicin γ1 genannt; Calicheamicin gamma 1.I oder Calicheamicin gamma 1), das auch synthetisch hergestellt werden kann.[8]
| Biogene Calicheamicine[9] | ||||||||
|---|---|---|---|---|---|---|---|---|
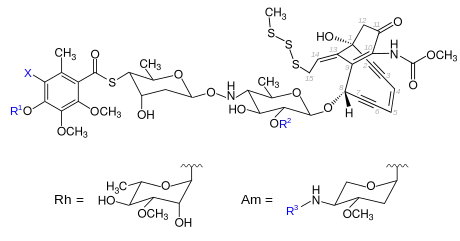 Strukturformel des Calicheamicin-Grundgerüsts | ||||||||
| Calicheamicin | X | R1 | R2 | R3 | CAS- Nummer |
PubChem | Summenformel | Molare Masse |
| α2 | I | H | Am | CH2CH3 | 103716-12-7 | 6450514 | C48H62IN3O17S4 | 1208,18 g·mol−1 |
| α3 | I | Rh | H | - | 103716-13-8 | 6450515 | C47H59IN2O19S4 | 1211,14 g·mol−1 |
| β1(Br) | Br | Rh | Am | CH(CH3)2 | 44307057 | C56H76BrN3O21S4 | 1335,37 g·mol−1 | |
| β1(I) | I | Rh | Am | CH(CH3)2 | C56H76IN3O21S4 | 1382,37 g·mol−1 | ||
| γ1(Br) | Br | Rh | Am | CH2CH3 | 44307331 | C55H74BrN3O21S4 | 1321,35 g·mol−1 | |
| γ1(I) | I | Rh | Am | CH2CH3 | 108212-75-5 | 10486648 | C55H74IN3O21S4 | 1368,35 g·mol−1 |
| δ1(I) | I | Rh | Am | CH3 | 44307145 | C54H72IN3O21S4 | 1354,32 g·mol−1 | |
Weitere in der Literatur beschriebene Calicheamicine sind bspw. das Calicheamicin θ1, ein synthetisches Analogon des Calicheamicin γ1, das anstelle des Methyltrisulfid-Triggers eine Thioacetatgruppe aufweist,[10][11] und der experimentell eingesetzte cycloaromatisierte γ1-Abkömmling Calicheamicin ε.[12] Calicheamicin T ist eine verkürzte Variante, deren glycosidische Komponente nur aus einem Disaccharid besteht.[12]
| Weitere Calicheamicine | |||||
|---|---|---|---|---|---|
| Calicheamicin | Strukturformel | CAS- Nummer |
PubChem | Summenformel | Molare Masse |
| θ1 |  Strukturformel von Calicheamicin theta 1 |
44403705 | C57H78IN3O22S2 | 1348,27 g·mol−1 | |
| ε | .svg.png.webp) Strukturformel von Calicheamicin epsilon |
128050-91-9 | 5488030 | C54H74IN3O21S2 | 1292,21 g·mol−1 |
| T | .svg.png.webp) Strukturformel von Calicheamicin T |
142518-72-7 | 6449957 | C32H43N3O11S3 | 741,89 g·mol−1 |
Wirkung
Calicheamicine tragen eine Endiin-Struktureinheit, von der bekannt ist, dass sie Bergman-Cyclisierungen eingeht und die dabei entstehenden Diradikale zu einem Doppelstrangbruch der DNA führen. Auch für die Calicheamicine wird ein solcher Wirkmechanismus diskutiert.[13]
Aufgrund der hohen systemischen Toxizität ist der therapeutische Einsatz der reinen Substanz (Calicheamicin γ1) nicht möglich; sie kommt vielmehr als Antikörper-Wirkstoff-Konjugat zur Anwendung, bei dem die zytotoxische Struktur über einen Linker an einen Antikörper gebunden wird. Der Antikörper ermöglicht den gezielten Angriff auf Krebszellen. Nach Aufnahme des Konjugats in das Innere der Krebszellen wird das zelltoxische Calicheamicin γ1 durch Hydrolyse aus dem Konjugat freigesetzt und entfaltet seine Wirkung; die Freisetzung während der systemischen Zirkulation ist nur äußerst gering.[14] Die Calicheamicin-γ1-Antikörper-Konjugate Gemtuzumab-Ozogamicin und Inotuzumab-Ozogamicin sind in der Hämatoonkologie verwendete Wirkstoffe.
Mythologie
Der griechische Dichter Hesiod beschreibt: Der Sage nach mussten die Götter, die gegen die Gesetze des Olymp verstießen, aus einem goldenen Kelch das Wasser des Styx trinken. Es wird angenommen, dass das Gestein unter dem Fluss Mavronero, welcher mit Styx assoziiert wurde, dicht mit Micromonospora echinospora besiedelt war, so dass die Menge des gelösten Calicheamicin aus einem Kelch ausreichte, tödlich zu sein.[15]
Geschichte
Angeblich wurde Alexander der Große durch einen Kelch Styx-Wasser getötet.[16] Die Geschichtsschreiber sagen, dass er unter starken Schmerzen und unstillbarem Durst gelitten habe, bevor er nach einer Woche starb. Das stimmt mit den Symptomen einer Calicheamicin-Vergiftung überein. Der griechische Geschichtsschreiber Pausanias schreibt, dass Ziegen, die versehentlich vom Wasser des Styx tranken, kurze Zeit später ohne erkennbaren Grund tot umgefallen seien.
Die Calicheamicine wurden (unter dem Namen Culture LL-E33288) Ende der 1980er Jahre bei Lederle im Zuge eines Screening-Programms entdeckt.[17][4] Möglich machte dies der 1979 beschriebene Lysogenic induction assay,[18] eine biochemische Methode, mit der sich bestimmte DNA-schädigende Wirkstoffe nachweisen lassen, die für die Krebschemotherapie von potenziellem Interesse sind. Micromonospora echinospora ssp. calichensis ist ein Bodenmikroorganismus aus der Klasse der Actinomyceten, der aus Proben von kalkhaltiger Bodenkruste („Caliche“) aus Texas isoliert wurde.[19]
Literatur
George A. Ellestad, Wei-dong Ding: Calicheamicin. In: Molecular Aspects of Anticancer Drug DNA Interactions, Volume 2, Stephen Neidle, Michael Waring (Hrsg.), CRC Press, 1994; S. 130 ff.
Einzelnachweise
- CAS-Nummer: 126629-10-5, PubChem ID: 10432424 .
- Theodor Dingermann: Pharmazeutische Biologie. Springer, 2002, ISBN 3-540-42844-5, S. 231 (eingeschränkte Vorschau in der Google-Buchsuche).
- K. C. Nicolaou, J. S. Chen, S. M. Dalby: From nature to the laboratory and into the clinic. In: Bioorganic & Medicinal Chemistry. Band 17, Nr. 6, März 2009, S. 2290–2303, PMID 19028103, PMC 2665039 (freier Volltext).
- May D. Lee, T. S. Dunne, Ching‐Fong Chang, Marshall M. Siegel, George O. Morton, George A. Ellestad, William J. McGahren, Donald B. Borders: Calicheamicins, a novel family of antitumor antibiotics. 4. Structure elucidation of calicheamicins .beta.1Br, .gamma.1Br, .alpha.2I, .alpha.3I, .beta.1I, .gamma.1I, and .delta.1I. In: Journal of the American Chemical Society. 1992, Band 114, Nummer 3, S. 985–997 doi:10.1021/ja00029a030.
- May D. Lee, Theresa S. Dunne, Marshall M. Siegel, Conway C. Chang, George O. Morton, Donald B. Borders: Calichemicins, a Novel Family of Antitumor Antibiotics. 1. Chemistry and Partial Structure of Calichemicin y1I, Journal of the American Chemical Society, Band 109, 1987, S. 3464–3466.
- May D. Lee, Theresa S. Dunne, Conway C. Chang, George A. Ellestad, Marshall M. Siegel, George O. Morton, William J. McGahren, Donald B. Borders: Calichemicins, a Novel Family of Antitumor Antibiotics. 2. Chemistry and Structure of Calichemicin y1I, Journal of the American Chemical Society, Band 109, 1987, S. 3466–3468.
- M. D. Lee, J. K. Manning, D. R. Williams, N. A. Kuck, R. T. Testa, D. B. Borders: Calicheamicins, a novel family of antitumor antibiotics. 3. Isolation, purification and characterization of calicheamicins beta 1Br, gamma 1Br, alpha 2I, alpha 3I, beta 1I, gamma 1I and delta 1I. In: The Journal of Antibiotics. Band 42, Nummer 7, Juli 1989, S. 1070–1087. PMID 2753814.
- Adrian L. Smith, Emmanuel N. Pitsinos, Cheol Kyu Hwang, Yukio Mizuno, Hiroyuki Saimoto, G. R. Scarlato, Toshio Suzuki, K. C. Nicolaou: Total synthesis of calicheamicin .gamma.1I. 2. Development of an enantioselective route to (-)-calicheamicinone. In: Journal of the American Chemical Society. 1993, Band 115, Nummer 17, S. 7612–7624 doi:10.1021/ja00070a005.
- Sofern nicht anders angemerkt, nach Lee et al. 1989, 1992.
- K. C. Nicolaou, Stephan Rigol, Emmanuel N. Pitsinos, Dipendu Das, Yong Lu, Subhrajit Rout, Alexander Schammel, Dane Holte, Baiwei Lin, Christine Gu, Hetal Sarvaiya, Jose Trinidad, Nicole Barbour, Amanda Valdiosera, Joseph Sandoval, Christina Lee, Monette Aujay, Hanan Fernando, Anukriti Dhar, Holger Karsunky, Nicole Taylor, Marybeth A. Pysz, Julia Gavrilyuk: Uncialamycin-based antibody–drug conjugates: Unique enediyne ADCs exhibiting bystander killing effect. In: Proceedings of the National Academy of Sciences. 2021, Band 118, Nummer 25 DOI:10.1073/pnas.2107042118.
- Aaron A. Salzberg, Peter C. Dedon: DNA Bending Is a Determinant of Calicheamicin Target Recognition†. In: Biochemistry. 2000, Band 39, Nummer 25, S. 7605–7612 DOI:10.1021/bi992227g.
- George A. Ellestad: Structural and conformational features relevant to the anti-tumor activity of calicheamicin γ 1I. In: Chirality. 2011, Band 23, Nummer 8, S. 660–671 DOI:10.1002/chir.20990.
- S. Walker, R. Landovitz, W. D. Ding, G. A. Ellestad, D. Kahne: Cleavage behavior of calicheamicin γ1 and calicheamicin T. In: Proceedings of the National Academy of Sciences of the United States of America. Band 89, Nr. 10, 1992, S. 4608–4612, doi:10.1073/pnas.89.10.4608, PMID 1584797, PMC 49132 (freier Volltext).
- Hans-Peter Lipp: Auf Umwegen, getarnt und durch die Hintertür , DAZ, Nr. 51, 2021, S. 36.
- Angelika Franz: Archäologie: Woche der Qualen. In: Spiegel Online. 2. August 2010, abgerufen am 29. Juli 2016.
- Alexander the Great poisoned by the River Styx. 4. August 2010, abgerufen am 8. August 2010.
- William M. Maiese, Mary P. Lechevalier, H. A. Lechevalier, Joseph D. Korshalla, N. A. Kuck, Amedeo A. Fantini, Mary Jo Wildey, J. Thomas, Michael Greenstein: Calicheamicins, a novel family of antitumor antibiotics. Taxonomy, fermentation and biological properties. In: The Journal of Antibiotics. 1989, Band 42, Nummer 4, S. 558–563 doi:10.7164/antibiotics.42.558.
- Rosalie K. Elespuru, Michael B. Yarmolinsky: A colorimetric assay of lysogenic induction designed for screening potential carcinogenic and carcinostatic agents. In: Environmental Mutagenesis. 1979, Band 1, Nummer 1, S. 65–78 DOI:10.1002/em.2860010113.
- Amit Kumar, Jason B. White, R. James Christie, Nazzareno Dimasi, Changshou Gao: Antibody-Drug Conjugates. In: Annual Reports in Medicinal Chemistry. 2017, S. 441–480 DOI:10.1016/bs.armc.2017.08.002.
