2-Butanol
2-Butanol (auch sec-Butanol oder nach IUPAC Butan-2-ol) ist eine chemische Verbindung und zählt als sekundärer, gesättigter Alkohol zu den Alkanolen.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
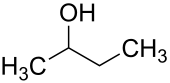 | ||||||||||||||||||||||
| Vereinfachte Strukturformel ohne Stereochemie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 2-Butanol | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C4H10O | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit alkoholartigem Geruch[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 74,12 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig[2] | |||||||||||||||||||||
| Dichte |
0,81 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
99 °C[2] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex |
1,3978 (20 °C)[5] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Vorkommen

Natürlich kommt 2-Butanol in Äpfeln (Malus domestica), Schwarzen Johannisbeeren (Ribes nigrum) und Myrte (Myrtus communis) vor.[8]
Isomere
2-Butanol ist das einzige Butanol mit einem Chiralitätszentrum, so dass zwei optisch aktive Enantiomere vorkommen. Wenn in diesem Artikel oder in der wissenschaftlichen Literatur „2-Butanol“ ohne eine zusätzliche Angabe zur Konfiguration erwähnt wird, ist stets das Racemat [(RS)-2-Butanol oder (±)-2-Butanol] gemeint.
| Isomere von 2-Butanol | ||
| Name | (S)-2-Butanol | (R)-2-Butanol |
| Andere Namen | (+)-2-Butanol | (−)-2-Butanol |
| Strukturformel | -2-Butanol.svg.png.webp) | -2-Butanol.svg.png.webp) |
| CAS-Nummer | 4221-99-2 | 14898-79-4 |
| 78-92-2 (Racemat) | ||
| EG-Nummer | 224-168-1 | 238-967-8 |
| 201-158-5 (Racemat) | ||
| ECHA-Infocard | 100.021.972 | 100.035.410 |
| 100.001.053 (Racemat) | ||
| PubChem | 444683 | 84682 |
| 6568 (Racemat) | ||
| DrugBank | − | − |
| DB02606 (Racemat) | ||
| Wikidata | Q27104553 | Q70731894 |
| Q209332 (Racemat) | ||
Gewinnung und Darstellung
Die technische Herstellung von racemischem 2-Butanol erfolgt meist durch indirekte Hydratisierung von 1-Buten und 2-Buten mit 70–80%iger Schwefelsäure bei Temperaturen von 40–50 °C.[9]
.svg.png.webp)
Die Hydratisierung verläuft zunächst über den Schwefelsäurehalbester, welcher dann unter Erhitzen mit Wasser gespalten wird. Nach der Regel von Markownikow liefern sowohl 1-Buten als auch 2-Buten denselben Alkohol.[9]
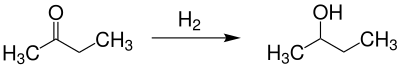
Man kann die racemische Form des 2-Butanol – also das Gemisch der zwei Enantiomere – durch Reduktion von 2-Butanon erhalten:
Eigenschaften
2-Butanol ist eine charakteristisch süßlich und durchdringend riechende farblose Flüssigkeit. 2-Butanol löst sich im Vergleich zu 1-Butanol besser in Wasser, und zwar zu 290 g·l−1 bei 25 °C.[4] Mit vielen organischen Lösungsmitteln ist es beliebig mischbar.
Sicherheitstechnische Kenngrößen
2-Butanol gilt als leicht entzündliche Flüssigkeit. Oberhalb des Flammpunktes können sich entzündliche Dampf-Luft-Gemische bilden. Die Verbindung hat einen Flammpunkt bei 23 °C.[2][10] Der Explosionsbereich liegt zwischen 1,65 Vol.‑% (51 g·m−3) als untere Explosionsgrenze (UEG) und 11 Vol.‑% (340 g·m−3) als obere Explosionsgrenze (OEG).[2][10] Der untere Explosionspunkt liegt bei 19 °C.[2] Die Sauerstoffgrenzkonzentration wurde mit 9,2 Mol.–% unter Stickstoff und 12,2 Mol.–% unter Kohlendioxid als Inertgas bestimmt.[11] Die Zündtemperatur beträgt 390 °C.[2][10] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
2-Butanol ist Bestandteil in Bremsflüssigkeiten, Abbeizmitteln und dient als Xanthogenat zur Herstellung von Flotationsmitteln. Des Weiteren ist es Bestandteil von Mischlösungsmitteln. Man nutzt es auch zur Synthese von Estern. Diese wiederum verwendet man in Aromen, Parfüms und als Lösemittel für Nitrocellulose.
Sicherheitshinweise
2-Butanol ist entzündlich und flüchtig. Die Dämpfe können mit Luft beim Erhitzen des Stoffes über seinen Flammpunkt, der bei 23 °C (geschlossener Tiegel)[2] liegt, ein explosionsfähiges Gemisch bilden. Sie sind schwerer als Luft und können Benommenheit und Schläfrigkeit verursachen. Das Einatmen oder Verschlucken des Stoffes kann zu Gesundheitsschäden führen. 2-Butanol reizt die Augen und die Atmungsorgane. 2-Butanol darf nicht in die Hände von Kindern gelangen.
Einzelnachweise
- Eintrag zu SEC-BUTYL ALCOHOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. März 2020.
- Eintrag zu 2-Butanol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- Eintrag zu Butanole. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Juni 2014.
- Donald B. Alger: The water solubility of 2-butanol: A widespread error. In: Journal of Chemical Education. 68 (11), 1991, S. 939; doi:10.1021/ed068p939.1.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-74.
- Eintrag zu Butan-2-ol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 78-92-2 bzw. sec-Butanol), abgerufen am 13. Oktober 2019.
- 2-BUTANOL (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 11. September 2021.
- Hans-Jürgen Arpe: Industrielle Organische Chemie: Bedeutende Vor- und Zwischenprodukte. 6. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2007, ISBN 978-3-527-31540-6, S. 223.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- S. Zakel, J. Förster, M. Mitu: Abschlussbericht zum PTB-Forschungsvorhaben 37064 Sauerstoffgrenzkonzentration von Alkoholen und Ketonen in Stickstoff und Kohlendioxid, PTB Braunschweig, Mai 2023 pdf.

