Bronopol
Bronopol (2-Brom-2-nitro-1,3-propandiol) ist eine chemische Verbindung aus der Gruppe der Diole, die bakteriostatisch und desinfizierend wirkt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
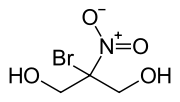 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Bronopol | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C3H6BrNO4 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 199,99 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
leicht löslich in Wasser (250 g·l−1 bei 22 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Eigenschaften
Die Verbindung wirkt durch Freisetzung von Formaldehyd,[5] die im Vergleich zu anderen Bioziden langsam verläuft.[6] Weiterhin besitzt Bronopol ein elektrophiles C-Atom, das mit nukleophilen Biomolekülen reagiert und dabei unter anderem Thiole in aktiven Zentren mancher Enzyme inaktiviert.[6] Durch beide Wirkmechanismen besitzt Bronopol ein breites Wirkungsspektrum und eine Anwendbarkeit von pH 5 bis 9, jedoch kann die Wirkung des Elektrophils durch organische Substanzen gemindert werden, und die Wirkung tritt mit bis zu 24 h vergleichsweise langsam ein.[6] Bronopol ist besonders wirksam gegen Pseudomonaden.[6] Aluminium, Eisen und Stoffe mit einer Mercaptogruppe (-SH) setzen die Aktivität von Bronopol herab. Bronopol erzeugt im Vergleich zu anderen Bioziden vergleichsweise wenig Kontaktdermatitis.[6] Bei neutralen oder basischen pH-Werten kann Bronopol Nitrit freisetzen, sodass sich in Anwesenheit von Aminen Nitrosamine bilden können.[6] Bronopol ist kompatibel mit quartären Ammoniumverbindungen und kationisch wirkenden Bioziden.[6]
Gewinnung und Darstellung
Bronopol wird durch Bromierung von Di(hydroxymethyl)nitromethan, welches sich von Nitromethan ableitet, gewonnen.[7]
Verwendung
Bronopol wurde ursprünglich als Konservierungsmittel für Arzneimittel verwendet. Aufgrund seiner geringen Warmblütertoxizität hat sich Bronopol zu einem breitverwendeten Konservierungsmittel in Haarwaschmitteln und Kosmetika entwickelt. Die Minimale Hemm-Konzentration (MHK) beträgt 0,0025 %, in Produkten wird es mit einer Konzentration von 0,02 % bis 0,1 % eingesetzt.[8] Es ist besonders wirksam gegen Pseudomonas aeruginosa.[9]
Sicherheit
Bronopol kann zur Bildung von Nitrosaminen führen.[10]
Siehe auch
Einzelnachweise
- Eintrag zu 2-BROMO-2-NITROPROPANE-1,3-DIOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 22. Mai 2020.
- Eintrag zu 2-Brom-2-nitro-1,3-propandiol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- Datenblatt 2-Bromo-2-nitro-1,3-propanediol, 98% bei Sigma-Aldrich, abgerufen am 21. Oktober 2013 (PDF).
- Eintrag zu Bronopol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Mustapha Kireche, Jean-Luc Peiffer, Diane Antonios, Isabelle Fabre, Elena Giménez-Arnau, Marc Pallardy, Jean-Pierre Lepoittevin, Jean-Claude Ourlin: Evidence for Chemical and Cellular Reactivities of the Formaldehyde Releaser Bronopol, Independent of Formaldehyde Release. In: Chemical Research in Toxicology. Band 24, Nr. 12, 19. Dezember 2011, S. 2115–2128, doi:10.1021/tx2002542.
- W. Paulus: Microbicides for the Protection of Materials: A Handbook. Springer Science & Business Media, 2012. ISBN 978-94-011-2118-7. S. 70–72.
- Sheldon B. Markofsky: Nitro Compounds, Aliphatic, S. 6 in Ullmann's Encyclopedia of Industrial Chemistry, 2012, Wiley-VCH, Weinheim, doi:10.1002/14356007.a17_401.pub2.
- Datenblatt (Memento vom 21. Oktober 2013 im Internet Archive) (PDF; 68 kB) von Schülke & Mayr.
- S. D. Gangolli, Royal Society of Chemistry (Great Britain): The Dictionary of Substances and Their Effects (DOSE): Volume 01 A–B. Royal Society of Chemistry, 1999, ISBN 0-85404-808-1, S. 723 (eingeschränkte Vorschau in der Google-Buchsuche).
- SCCS: Opinion on Nitrosamines and Secondary Amines in Cosmetic Products, S. 18.


