Brasilin
Brasilin ist ein Naturfarbstoff.[3] Es wurde erstmals im Jahre 1808 vom französischen Chemiker Eugène Chevreul aus Brasilholz isoliert.[1] Aufgrund seiner chemischen Struktur wird Brasilin der Stoffgruppe der Neoflavonoide zugerechnet.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
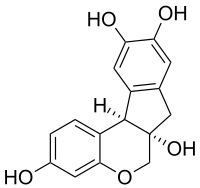 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Brasilin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C16H14O5 | ||||||||||||||||||
| Kurzbeschreibung |
blassgelbe Nadeln[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 286,28 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Eigenschaften
Brasilin bildet blassgelbe Nadeln und zeigt Fluoreszenz.[1][4]
Neuere Studien weisen auf eine pharmakologische Wirksamkeit des Brasilins als Antagonist des Kollagenrezeptors hin.[5] Brasilin wirkt auf manche Tumorzellen in Zellkultur toxisch durch Induktion von Apoptose.[6] Brasilin hat eine antibakterielle Wirkung.[7]
Brasilin kann durch eine Extraktion mit Methanol aus zerkleinerten Rothölzern gewonnen werden.[8] Daneben wurden auch verschiedene Synthesewege des Brasilin beschrieben.[9][10] Im Vergleich zum verwandten Farbstoff Hämatoxylin fehlt Brasilin eine Hydroxygruppe. Ausgehend von Brasilin können Alkaloidanaloga hergestellt werden.[11]
Verwendung

Brasilin wurde früher als Farbstoff verwendet und ist neben seinem Oxidationsprodukt Brasilein der färbende Hauptbestandteil vieler Rotholz-Arten, deren Kernhölzer wurden früher in der Woll- und Baumwollfärberei verwendet.[1] Bei der Lagerung oder durch Zerraspeln des geschlagenen Holzes oxidiert das Brasilin langsam zum Brasilein. In Nürnberg ist der Beruf des Brasilholzstoßers für das 16. Jahrhundert belegt.[12] Heute werden vor allem Bögen für Streichinstrumente aus dem gefärbten Holz gefertigt.[13]
Zusammen mit dem tiefroten Brasilein dient es auch als Säure-Base-Indikator.[14] In der Histologie wird Brasilin zur Färbung von Zellkernen in Nervengeweben verwendet.[15] In der Malerei wurde Brasilin als rote Farbe mit einem Beizsalz (auch Mordant) verwendet, wodurch es einen schwerlöslichen Farbstoffkomplex bildet.
Einzelnachweise
- Eintrag zu Brasilin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 23. Juni 2014.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Luiz F.C. De Oliveira, Howell G.M. Edwards, Eudes S. Velozo, M. Nesbitt: Vibrational spectroscopic study of brazilin and brazilein, the main constituents of brazilwood from Brazil. In: Vibrational Spectroscopy. 28. Jahrgang, Nr. 2, 2002, S. 243, doi:10.1016/S0924-2031(01)00138-2.
- R. Rondão, J. S. Seixas de Melo, J. Pina, M. J. Melo, T. Vitorino, A. J. Parola: Brazilwood reds: the (photo)chemistry of brazilin and brazilein. In: The journal of physical chemistry. A. Band 117, Nummer 41, Oktober 2013, S. 10650–10660, doi:10.1021/jp404789f. PMID 24050687.
- Y. Chang, S. K. Huang, W. J. Lu, C. L. Chung, W. L. Chen, S. H. Lu, K. H. Lin, J. R. Sheu: Brazilin isolated from Caesalpinia sappan L. acts as a novel collagen receptor agonist in human platelets. In: Journal of biomedical science. Band 20, 2013, S. 4, doi:10.1186/1423-0127-20-4. PMID 23350663. PMC 3564834 (freier Volltext).
- D. Y. Lee, M. K. Lee, G. S. Kim, H. J. Noh, M. H. Lee: Brazilin inhibits growth and induces apoptosis in human glioblastoma cells. In: Molecules. Band 18, Nummer 2, 2013, S. 2449–2457, doi:10.3390/molecules18022449. PMID 23429418.
- H. X. Xu, S. F. Lee: The antibacterial principle of Caesalpinia sappan. In: Phytotherapy research: PTR. Band 18, Nummer 8, 2004, S. 647–651, doi:10.1002/ptr.1524. PMID 15476302.
- Y. Lu, H. Bai, C. Kong, H. Zhong, M. C. Breadmore: Analysis of brazilin and protosappanin B in sappan lignum by capillary zone electrophoresis with acid barrage stacking. In: Electrophoresis. Band 34, Nummer 24, Dezember 2013, S. 3326–3332, doi:10.1002/elps.201300402. PMID 24150968.
- X. Wang, H. Zhang, X. Yang, J. Zhao, C. Pan: Enantioselective total synthesis of (+)-brazilin, (–)-brazilein and (+)-brazilide A. In: Chemical communications. Band 49, Nummer 47, Juni 2013, S. 5405–5407, doi:10.1039/c3cc42385a. PMID 23657435.
- Y. Huang, J. Zhang, T. R. Pettus: Synthesis of (+/-)-brazilin using IBX. In: Organic letters. Band 7, Nummer 26, Dezember 2005, S. 5841–5844, doi:10.1021/ol0523749. PMID 16354080. PMC 2423948 (freier Volltext).
- P. Pfeiffer, J. Breitbach, W. Scholl: Alkaloidartige Verbindungen aus Brasilin und Hämatoxylin. In: Journal für Praktische Chemie. Band 154, 1940, S. 157–208, doi:10.1002/prac.19401540601.
- Sabine Struckmeier: Die Textilfärberei vom Spätmittelalter bis zur Frühen Neuzeit (14.-16. Jahrhundert): Eine naturwissenschaftlich-technische Analyse deutschsprachiger Quellen. Waxmann Verlag, 2011, ISBN 978-3-8309-7527-4, S. 185 (eingeschränkte Vorschau in der Google-Buchsuche).
- Einträge zu Caesalpinia, in der Nutzpflanzen-Datenbank der Universität Marburg, abgerufen am 2. April 2018.
- Eintrag Brasilin im Lexikon der Biologie auf spektrum.de
- V. Augulis, J. Sepinwall: Brazilin-toluidine blue O and hematoxylin-darrow red methods for brain and spinal cord. In: Stain technology. Band 44, Nummer 3, Mai 1969, S. 131–137, PMID 4181667.