Brücke (Chemie)
Der Begriff Brücke beschreibt in chemischen Strukturformeln Verknüpfungen von Teilstrukturen in Molekülen durch Atome, Atomketten und Bindungen. Er hat jedoch unterschiedliche Bedeutungen in den Teilgebieten der Chemie.
Im IUPAC Kompendium der Chemischen Terminologie („Gold Book“) wird „Brücke“ (englisch bridge) folgendermaßen definiert:
“A valence bond or an atom or an unbranched chain of atoms connecting two different parts of a molecule.”[1]
Als verknüpft („verbrückt“, englisch bridged) werden also Atome im selben Molekül, d. h. intramolekular, betrachtet. Die Definition wurde aber auch auf Verknüpfungen verschiedener Moleküle ausgedehnt, d. h. intermolekulare Brücken.
Nach der IUPAC-Definition kann eine Brücke nicht nur aus Atomen oder (unverzweigten) Ketten von Atomen bestehen, sondern auch eine Bindung sein, in der Regel eine kovalente. Letzteres hat historische Gründe.
Atombrücken – Elementbrücken
Nach der Art der Atome lassen sich Brücken eindeutig klassifizieren. So spricht man zum Beispiel von Wasserstoffbrücken, Stickstoffbrücken, Sauerstoffbrücken, Schwefelbrücken und Halogenbrücken.
 |
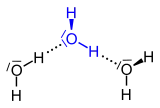 |
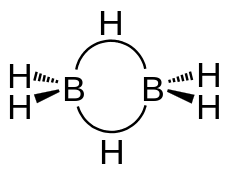
| Dreizentrenbindung in Diboran | Wasserstoffbrückenbindungen (gepunktet gezeichnet) in Wasser |
Wasserstoff als Brückenatom findet sich im Diboran, Aluminiumhydrid (Alan, (AlH3)x) und einigen ihrer Alkyl-Derivate. Diese Moleküle werden auch als Metallkomplexe betrachtet, wobei die H-Atome als Brückenliganden bezeichnet werden.[2][3]
Für die nicht kovalenten Bindungen in diesen Molekülen wurden verschiedene Modelle entwickelt, z. B. das der Dreizentrenbindung. Ein anderer, in der Natur weitaus wichtigerer Brückentyp ist die Wasserstoffbrückenbindung. Sie verknüpft – im einfachsten Falle – H2O-Moleküle oder Moleküle von Fluorwasserstoff (HF).
 |
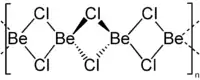 |
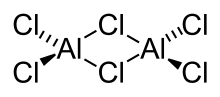
| Aluminiumchlorid, Dimer in der Gasphase | Berylliumchlorid, Kettenpolymer |
Halogenatome verbrücken Al(Hal)3-Strukturen in Aluminiumchlorid und Aluminiumbromid, wodurch diese Moleküle als Dimere vorliegen können. Die Assoziation kommt durch koordinative Bindungen zustande. Beim Berylliumchlorid erzeugen die Chlorbrücken eine Kettenstruktur.
Brücken mit Kohlenstoffatomen


Dieisennonacarbonyl, Tri-μ-carbonyl-bis(tricarbonyleisen) Dimeres Triethylaluminium mit Dreizentrenbindungen
Metallkomplexe und metallorganische Verbindung
Viele Metallkomplexe der anorganischen Chemie enthalten Kohlenstoffatome, welche als Teile von Brückenliganden betrachtet werden können. Da C-Atome vierbindig sind, sind die Strukturen komplizierter. Eine Alkylgruppe kann in Komplexverbindungen Metallatome verbrücken. Carbonylbrücken lassen sich im Nonacarbonyldieisen (Dieisennonacarbonyl) und weiteren „Carbonylkomplexen“ identifizieren.
Verbrückende Liganden werden im Namen und in der Summenformel des Stoffes mit dem Präfix μn- bezeichnet, wobei n für den Grad der Verbrückung (die Anzahl der Metallzentren, an die der Ligand koordiniert) steht. Üblicherweise wird μ1 weggelassen und μ2 mit μ abgekürzt.[4] Der systematische Name von Nonacarbonyldieisen ist damit Tri-μ-carbonyl-bis(tricarbonyleisen), die Summenformel [{Fe(CO)3}2(μ-CO)3]. Das dimere Triethylaluminium ist systematisch Di-μ-ethyl-bis(diethylaluminium) beziehungsweise [(AlEt2)2(μ-Et)2] (Et = C2H5).
Kohlenwasserstoffe


Historisch gesehen wurde der Begriff „Brücke“ erstmals zur Beschreibung der Struktur einiger cyclischer Kohlenwasserstoffe durch Adolf von Baeyer verwendet.[5] Baeyer betrachtete Kohlenwasserstoffe wie Norbornan als verbrückt und entwickelte aus dieser Betrachtung eine Nomenklatur für bicyclische Verbindungen (Von-Baeyer-Nomenklatur). Während im Norbornan eine Atombrücke mit dem Element Kohlenstoff identifiziert werden kann, liegt im Norcaran eine Kovalenzbrücke vor, welche zwei C-Atome verknüpft. Näheres im Artikel Verbrückte Kohlenwasserstoffe. Die Verknüpfungsstellen einer Brücke (die tertiären Kohlenstoffatome) werden „Brückenköpfe“ genannt. Norbornan wird systematisch Bicyclo[2.2.1]heptan genannt.
In bi- und polycyclischen Ringsystemen definierte Baeyer auch Bindungen als Brücke. Er nannte sie direkte Brücken. Da diese Brücken kein Atom enthalten, charakterisierte er sie durch die Zahl Null.[5] Norcaran ist also Bicyclo[4.1.0]heptan. Weitere Beispiele siehe den Artikel Von-Baeyer-Nomenklatur.
![[7]Metacyclophan](../I/7Metacyclophan.svg.png.webp)
![[2.2]Paracyclophan](../I/Paracyclophan.svg.png.webp)
[7]Metacyclophan, [7](1,3)Cyclophan [2.2]Paracyclophan, [2.2](1,4)Cyclophan
Andere verbrückte Kohlenwasserstoffe sind die Cyclophane, Verbindungen mit einem oder mehreren Benzolringen, die durch aliphatische Ketten verbrückt sind und damit eine Art Henkel bilden (ansa-Verbindungen).
Heterocyclen
Heterocyclen können formal von cyclischen Kohlenwasserstoffen abgeleitet werden, indem man ein C-Atom (oder mehrere) durch Atome anderer Elemente austauscht („Heteroatome“). Heterocyclen können also Atombrücken enthalten und außerdem durch kovalente Bindungen verbrückt sein. Bei Heterocyclen gibt es Definitionsprobleme zur Abgrenzung zwischen den Begriffen Brücke und Funktionelle Gruppe oder Stoffklasse (Stoffgruppe). Es wird empfohlen, Heteroatome in „einfachen“, d. h. monocyclischen Heterocyclen nicht als Brücken zu bezeichnen, sondern als Funktionelle Gruppe.
Der Terminus „Brücke“ wird vor allem zur Beschreibung der Struktur komplizierterer Moleküle aus der Natur (Naturstoffe und ihre Derivate) und biologisch aktiver Stoffe in der pharmazeutischen Chemie benutzt.
Beispiele:


Das bicyclische tertiäre Amin Tropan (N-Methyl-8-aza-bicyclo[3.2.1]octan) und die davon abgeleiteten Derivate, z. B. Cocain, enthalten eine Stickstoffbrücke, durch welche zwei Kohlenstoffatome des Cycloheptan-Gerüsts verknüpft werden.
Im Morphin ist sowohl eine Stickstoffbrücke als auch eine Sauerstoffbrücke vorhanden. Als funktionelle Gruppen betrachtet, sind diese Brücken tertiäre Amin- bzw. Ether-Gruppen.
Die Glycosidische Bindung verknüpft Kohlenhydrat-Moleküle miteinander oder mit anderen Strukturelementen (Aglycon). Die Verknüpfung kann als Sauerstoffbrücke betrachtet werden. Ersetzt man diese durch eine Methylenbrücke, so erhält man pharmazeutisch interessante „C-Glycoside“.
Brücken in Makromolekülen

Auch Makromoleküle können durch Atome, meistens Ketten von Atomen, verbrückt sein. Das älteste Beispiel ist vermutlich die Vulkanisation von Kautschuk; bei diesem Prozess bilden sich Schwefelbrücken zwischen den Polyisopren-Ketten.
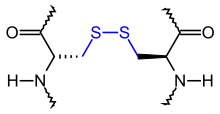
In der Biochemie sind Brücken in Proteinen und Peptiden wichtig, vor allem Disulfidbrücken (Cystin-Brücken), d. h. Schwefelbrücken.
Schließlich wurde der Begriff „Brücke“ auch auf Ionenbindungen übertragen. Ketten und Ringe von Makromolekülen können dadurch in bestimmten Konformationen fixiert werden. In der Biochemie ist für diese Art von Wechselwirkung der Begriff „Salzbrücke“ gebräuchlich. Salzbrücken entstehen, wenn in einer Proteinkette positiv geladene funktionelle Gruppen negativ geladene, d. h. anionische Gruppen elektrostatisch anziehen (Coulomb-Wechselwirkung). Typische „Salzpaare“ sind Guanidinium-Kationen (Arginin-Peptide) oder Ammonium-Gruppen (Lysin-Peptide) kombiniert mit Carboxylat-Anionen (aus Glutamat-Bausteinen).
Siehe auch
Literatur
- Otto-Albrecht Neumüller (Hrsg.): Duden – Das Wörterbuch chemischer Fachausdrücke. Dudenverlag, Mannheim 2003, ISBN 3-411-04171-4.
- Eintrag zu Brücken. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. Juni 2014.
Einzelnachweise
- Eintrag zu bridge. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.B00736.
- International Union of Pure and Applied Chemistry [IUPAC], Wolfgang Liebscher, unter Mitarbeit von J. Neels (Hrsg.): Nomenklatur der anorganischen Chemie. Deutsche Ausgabe der Empfehlungen 1990. VCH, Weinheim u. a. O. 1995, ISBN 3-527-29340-X.
- Eintrag zu bridging ligand. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.B00741 – Version: 2.3.2.
- Erwin Riedel (Hrsg.): Moderne Anorganische Chemie. 3. Auflage. Walter de Gruyter, Berlin/New York 2007, ISBN 978-3-11-019060-1, S. 385.
- Adolf Baeyer: Systematik und Nomenclatur bicyclischer Kohlenwasserstoffe. In: Berichte der Deutschen Chemischen Gesellschaft. Band 33, 1900, S. 3771–3775, doi:10.1002/cber.190003303187.