Bleiakkumulator
Ein Bleiakkumulator (kurz Bleiakku) ist ein Akkumulator, bei dem die Elektroden aus Blei bzw. Bleidioxid und der Elektrolyt aus verdünnter Schwefelsäure bestehen.

Bleiakkumulatoren gelten für eine Lebensdauer von einigen Jahren als zuverlässig und preisgünstig. Im Vergleich mit anderen Akkumulatortypen haben sie im Verhältnis zum Volumen eine große Masse sowie mit etwa 0,11 MJ/kg eine geringe Energiedichte. Bezogen auf das Volumen ist die Energiedichte der anderer Akkumulatoren ähnlich. Die bekannteste Anwendung ist die Starterbatterie für Kraftfahrzeuge. Auch werden sie als Energiespeicher für Elektrofahrzeuge eingesetzt. Wegen der großen Masse und ihrer Temperaturabhängigkeit sind sie hierfür allerdings nur eingeschränkt verwendbar. Das hohe Gewicht kann aber auch vorteilhaft genutzt werden, beispielsweise in Gabelstaplern, bei denen der Bleiakkumulator gleichzeitig als Gegengewicht an der Hinterachse dient.
Geschichte
Luigi Galvani legte durch die Entdeckung der Muskelkontraktionen bei toten Fröschen durch Berührung mit Eisen und Kupfer die Grundlage zur Entwicklung der galvanischen Zelle durch Alessandro Volta im Jahre 1792. Volta erkannte, dass die zuckenden Froschschenkel in Galvanis Versuch eine physikalische Grundlage haben, er untersuchte daraufhin die Kontaktspannung verschiedener Metalle und entwickelte die elektrochemische Spannungsreihe. 1802 entwickelte Johann Wilhelm Ritter ein ähnliches System, jedoch waren Ritters Zellen – im Gegensatz zu Voltas Zellen – nach der Entladung wieder aufladbar. Dieses wiederaufladbare Sekundärsystem war eine Vorform für heute bekannte Akkumulatoren.
1854 entwickelte der deutsche Mediziner und Physiker Wilhelm Josef Sinsteden den ersten Bleiakkumulator. Sinsteden stellte zwei große Bleiplatten, die sich gegenseitig nicht berührten, in ein Gefäß gefüllt mit verdünnter Schwefelsäure. Durch Anschließen einer Spannungsquelle und häufiges Auf- sowie Entladen (Formieren) erreichte er nach einer gewissen Zeit eine messbare Kapazität. An einer der Platten bildete sich Bleidioxid (Blei(IV)-oxid), und an der anderen reines Blei. 1859 wurde Sinstedens Bleiakkumulator von Gaston Planté durch eine spiralförmige Anordnung der Bleiplatten weiterentwickelt. Nach diesem Prinzip werden auch noch in jüngerer Zeit Akkumulatoren gebaut.
In der Industrie gab es zunächst kaum Verwendung für Strom speichernde Zellen, dies änderte sich erst zwanzig Jahre später. 1866 entwickelte Werner von Siemens den elektrischen Generator und die Nachfrage nach Möglichkeiten zur Speicherung der elektrischen Energie stieg rasant an. 1880 wurde der Bleiakkumulator vom französischen Ingenieur Camille Alphonse Faure entscheidend weiterentwickelt, durch eine Beschichtung aus Bleipulver und Schwefel erreichte der Bleiakkumulator bereits nach wenigen Ladezyklen (dem Formieren) eine hohe Kapazität.[1]
Den ersten großen wirtschaftlichen Erfolg hatte Henri Tudor mit seinen Bleiakkumulatoren. Bereits 1882 soll es ihm gelungen sein, eine Gleichstromanlage unter Benutzung eines Wasserfalles zu entwerfen, die diverse Bleiakkumulatoren stetig wieder aufladen konnte. Er verwendete hierzu das Wasserrad der Mühle auf dem Landsitz seiner Eltern, dem sogenannten Irminenhof. Dieses System verwendete er, um die elektrische Beleuchtung im Irminenhof zu realisieren. Der Irminenhof war somit eines der ersten privaten Gebäude in Europa, das durchgehend elektrisches Licht hatte. Der erste große Auftrag für Tudor war die elektrische Beleuchtung in der Stadt Echternach im Jahr 1886.[2]
1887 wurde von Adolph Müller die erste Akkumulatorenfabrik Deutschlands gegründet, aus ihr entwickelte sich später der Konzern VARTA.
Im Jahr 1910 wurden bereits 70.000 Tonnen Blei für Bleiakkumulatoren verwendet. Sie wurden als stationäre und transportable Gleichstromquellen für die Schwachstromtechnik eingesetzt.
Aufbau


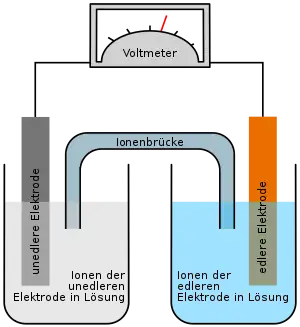
Ein Bleiakkumulator besteht aus einem säurefesten Gehäuse und zwei Bleiplatten oder Plattengruppen, von denen die eine als positiv und die andere als negativ gepolte Elektrode dienen, sowie eine Füllung von 37-prozentiger (Massenanteil) Schwefelsäure (H2SO4) als Elektrolyt. Bei der handelsüblichen Ausführung sind die Elektrodenplatten dicht ineinander geschachtelt, dazwischen befinden sich Separatoren zum Beispiel aus perforiertem, gewelltem Polyvinylchlorid (PVC), die eine direkte gegenseitige Berührung (Kurzschluss) verhindern. Die Anschlüsse und Verbindungslaschen bestehen unter anderem bei Starterbatterien aus metallischem Blei.
Im entladenen (neutralen) Zustand lagert sich an beiden Elektrodengruppen eine Schicht aus Blei(II)-sulfat (PbSO4) ab. Im aufgeladenen Zustand haben die positiven Elektroden eine Schicht aus Blei(IV)-oxid (PbO2), die negativ gepolten Elektroden bestehen aus mehr oder weniger porösem Blei (Bleischwamm).
.png.webp)
Die Säuredichte ist gleichzeitig ein Maß für den Ladezustand. Sie beträgt bei aufgeladenem Akkumulator ca. 1,28 g/cm³ (100 % Ladung) und bei entladenem Akkumulator 1,10 g/cm³ (Entladung 100 %, Tiefentladung). Der Lade- oder Entladezustand ist linear verknüpft mit der Elektrolytdichte und verändert sich pro 0,01 g/cm³ um ca. 5,56 %, zum Beispiel 1,28 g/cm³→100 %, 1,19 g/cm³→50 %, 1,104 g/cm³→2 % Restkapazität.
Wirkungsweise
Die Wirkungsweise des Bleiakkumulators lässt sich anhand der bei der Ladung und Entladung bzw. der Stromentnahme ablaufenden chemischen Prozesse darstellen.
Bei der Entladung laufen folgende chemische Vorgänge ab:
Negativer Pol:
Positiver Pol:
Die Entladung besteht in einer spontanen Komproportionierung.
Beim Laden laufen die Vorgänge in Gegenrichtung ab, es handelt sich um eine erzwungene Disproportionierung.
Die Gesamtreaktion beim Entladen und Laden:
Nach rechts findet unter Energieabgabe die Entladung des Bleiakkus statt, nach links unter Energiezufuhr die Aufladung.
Aus der elektrochemischen Spannungsreihe kann man nun die Potentialdifferenz, also letztlich die elektrische Spannung, die entsteht, berechnen.
Selbstentladung:
Blei(IV)-oxid ist in schwefelsaurer Lösung unbeständig.
Die Überspannung des Wasserstoffs, die das Laden eines Bleiakkumulators überhaupt erst möglich macht,[3] verlangsamt die elektrolytische Selbstentladung.
Gebrauchseigenschaften
Die Nennspannung einer Zelle beträgt 2 V, die Spannung schwankt jedoch je nach Ladezustand, Temperatur und Lade- oder Entladestrom zwischen ca. 1,75 und 2,4 V. Die Energiedichte beträgt 0,105 bis 0,16 MJ/kg (29 bis 44 Wh/kg)[4], während moderne NiMH-Zellen Werte zwischen 0,28 und 0,37 MJ/kg (80 bis 105 Wh/kg)[5] und Lithium-Akkus Werte bis 0,95 MJ/kg (260 Wh/kg) erreichen.[6]
Bleiakkumulatoren können kurzzeitig hohe Stromstärken abgeben, sie haben also eine hohe Leistungsdichte. Diese Eigenschaft ist zum Beispiel für Fahrzeug- und Starterbatterien notwendig und gehört zur Stärke des Bleiakkumulators. Allerdings können mittlerweile Hochstrom-Lithiumionenakkus wesentlich höhere Stromstärken abgeben und wesentlich höhere Leistungsdichten (Faktor 8 bis 9) erreichen. Hochkapazitive Lithiumionenakkus liegen etwas oberhalb von Bleiakkus (Faktor 1,5 bis 2).[7]
Andererseits führen Kurzschlüsse wegen dieser Eigenschaft zu extrem hohen Stromstärken, die zu Verbrennungen (Erhitzung von Werkzeugen) oder Bränden (Verkabelung) führen können. Bei einem Kurzschluss können sich die Elektroden verformen.
Zur Vermeidung von versehentlichen Kurzschlüssen sollten Starterbatterien immer erst am Masse-Pol (beim Kfz Minus-Pol) getrennt und zuletzt an diesem angeschlossen werden. Damit wird die Möglichkeit eines Kurzschlusses vermieden, der sich durch das Hantieren am Plus-Pol und gleichzeitiger Berührung des Fahrzeugchassis bei nicht abgeklemmtem Masse-Pol ergeben kann (z. B. durch Abrutschen eines leitenden Werkzeugs).
Die für das Laden des Bleiakkus notwendige Überspannung des Wasserstoffes kann durch Verunreinigungen von Edelmetallen und Eisen, Nickel und Kobalt gestört werden. Befinden sich (etwa aus verunreinigtem Blei) solche Metallsalze in der Schwefelsäure, lagern sich die entsprechenden Metalle beim Laden bevorzugt auf der Oberfläche an der Bleielektrode an und bilden dort Lokalemente, an denen die Überspannung des Wasserstoffs verringert ist. Dann entwickelt der Akku beim weiteren Laden nur noch Wasserstoff; er „gast“ aus und bildet keine Bleiüberzüge mehr. Solche Akkus lassen sich dann nicht wieder aufladen.[3][8] Grundsätzlich kann bei den Ladevorgängen Knallgas entstehen. Knallgas kann auch bei Selbstentladung entstehen,[9] insbesondere nach Reduzierung der Überspannung des Wasserstoffs durch Verunreinigungen. Bei einigen Bauarten wird das gebildete Knallgas indes über eine z. B. im Batteriedeckel vorhandene Katalysatorpatrone zu Wasser rekombiniert, so dass kein Wasser durch Gasung verloren geht und die Batterie entsprechend wartungsärmer und sicherer ist.[9][10] Etwaig entweichendes Knallgas kann sich hingegen durch Funken entzünden und zu gefährlichen Verpuffungen führen. Die Gefahr der Funkenbildung besteht vor allem beim An- oder Abklemmen der Batterieanschlüsse oder bei elektrostatischer Aufladung (zum Beispiel des Kunststoffgehäuses durch Reiben) oder nach Betätigen des Anlassers durch Induktionsspannungen. Daher müssen geschlossene Räume, in denen Bleiakkumulatoren geladen werden, sicherheitshalber belüftet werden.[11]
Pflege und Lebensdauer

Bleiakkus können eine recht hohe Lebensdauer von mehreren Jahren erreichen. Während ungenügend geregelte Akkumulatoren als Starterbatterie oft nur 2 bis 4 Jahre einsetzbar sind, können hochwertige Ausführungen bis zu 10 Jahre ihre Funktion erfüllen. Antriebsbatterien (Traktionsbatterien) oder Speicherbatterien können je nach Qualität und Belastung zwischen 5 und 15 Jahre Lebensdauer erreichen. Bei Bleiakkumulatoren gleicher Kapazität und Größe, aber mit verschiedenem Gewicht, ist in der Regel der schwerere Akkumulator länger haltbar, da die Bleigerüste stärker ausgeführt sind. Die Belastbarkeit im Neuzustand ist davon nicht direkt beeinflusst, da auch eine schwächere Blei-Struktur mit großer aktiver Oberfläche ausgeführt werden kann (Strukturierung). Generell altern Akkumulatoren und zählen als Verschleißteil. Das liegt bei Bleiakkumulatoren in erster Linie an der inneren Korrosion (bei nur äußerer Korrosion, siehe auch: Polfett) der Bleigerüste der Elektroden, an der Entstehung von feinen Kurzschlüssen und an der Sulfatierung des Bleis, die bewirkt, dass sich die PbSO4-Kristalle zu immer größeren Verbünden zusammenschließen. So verringert sich die elektrochemisch aktive Oberfläche des PbSO4. Durch diese kleinere Oberfläche löst sich das PbSO4 immer schlechter. So dauert es sehr lange, bis eine hinreichend hohe Konzentration an Pb2+ vorliegt. Außerdem ist die elektrische Leitfähigkeit des Sulfats geringer als diejenige von Blei. Der dadurch erhöhte Innenwiderstand der Zelle führt bei Belastung zu einem stärkeren Spannungsabfall.
Zum Aufladen muss ein passender Laderegler verwendet werden, um die vor allem bei geschlossenen gebundenen Bleiakkumulatoren (Blei-Gel, Blei-Vlies) schädliche Überladung zu vermeiden und die Gasung zu beschränken. Bei offenen Bleiakkumulatoren mit flüssigem Elektrolyt ist Überladung weniger kritisch, da die durch Ausgasung entstandenen Verluste mit destilliertem Wasser ausgeglichen werden können und die Gasung zu einer Durchmischung der Säure führt und eine nachteilige Säureschichtung verhindert. Für Bleiakkumulatoren geeignete Laderegler stellen einen maximalen Ladestrom zur Verfügung, bis die Zellenspannung einen typischen Wert von 2,3 bis 2,35 V erreicht hat, anschließend halten sie die Spannung konstant.
Bleiakkumulatoren sollten nicht tiefentladen (Zellenspannungen unter 1,7 V) werden,[12] da dies den Akkumulator unbrauchbar machen kann. Unter diesem Wert gilt ein Akkumulator als tiefentladen und ist möglichst umgehend geeignet aufzuladen.[13][14][15] Ein Tiefentladeschutz kann Tiefentladung verhindern, während der Laderegler vor Überladung schützt.
Verunreinigungen im Elektrolyten wie zum Beispiel Eisen- oder Edelmetallsalze setzen die Überspannung des Wasserstoffs herab und leiten deshalb eine spontane Selbstentladung ein.
Ladeverfahren
Zum Aufladen ist ein Ladegerät zu verwenden. Die im Gerät enthaltene elektronische Schaltung, der Laderegler, steuert den Ladevorgang und setzt das Ladeverfahren um.
Im Wesentlichen durchläuft die Ladung die Phasen
- Hauptladung
- Boostladung
- Ausgleichsladung (nur Nassakkus)
- Ladungshaltung (float)
Für Dauerbetrieb geeignete Laderegler stellen einen Ladestrom zur Verfügung, der in Ampere (A) üblicherweise 1/10 der Kapazität in Amperestunden (Ah) des Akkus entspricht. Dieser wird aufrechterhalten, bis die Zellenspannung einen typischen Wert von 2,3 bis 2,35 V erreicht hat. Anschließend wird die Betriebsart automatisch auf Konstantspannung umgeschaltet, der die Selbstentladung ausgleicht.
Der Laderegler dient bei geschlossenen gebundenen Bleiakkumulatoren (Blei-Gel, Blei-Vlies) insbesondere dazu, schädliche Überladung zu vermeiden und die Gasung zu beschränken. Bei zellspannungsgesteuerten Ladegeräten wird in der Hauptladephase die Zellspannung überwacht, bis diese 2,35 V je Zelle erreicht hat. Danach wird die Ladespannung für wenige Stunden auf 2,4 V angehoben, um danach auf die Ladehaltungsspannung zu reduzieren.
Bei offenen Bleiakkumulatoren mit flüssigem Elektrolyt ist Überladung weniger kritisch, da die durch Ausgasung entstandenen Verluste mit destilliertem Wasser ausgeglichen werden können. Die Gasung ist bei Nass-Bleiakkus sogar erwünscht, da die aufsteigenden Gasbläschen nach dem Prinzip der Mammutpumpe eine Durchwälzung der Säure bewirkt und so eine sich im Laufe der Zeit mögliche Ausbildung von Säureschichten verschiedener Dichten vermindert.
Verwendung

Wichtig für die Verwendung sind vor allem die Zuverlässigkeit, Verfügbarkeit und Wirtschaftlichkeit durch niedrige Kosten. In Deutschland nahm der Bleiakkumulator aufgrund der großen Erfahrungen durch den Einsatz in U-Booten ab dem Ersten Weltkrieg eine herausragende Stellung bei Forschung und Produktion ein. Allerdings steht die Wirtschaftlichkeit von Bleiakkumulatoren durch fallende Kosten für andere Akkumulatorensysteme, vor allem bei robusten Lithium-Eisenphosphat-Akkumulatoren zunehmend in Frage. Hinzu kommt der Nachteil des hohen Gewichts, das ein Hemmnis in der Elektromobilität ist, weil dadurch die Reichweite des Fahrzeugs vermindert wird. Gegenüber Lithium-Akkumulatoren haben Bleiakkumulatoren im stationären Einsatz (zum Beispiel als Solarbatterie) den Vorteil, dass sie kein Batteriemanagementsystem zur Überwachung der Akkuzellen benötigen. Stationäre Speichersysteme mit Bleiakkumulator können daher günstiger angeboten werden und arbeiten üblicherweise wirtschaftlicher als Systeme mit Lithium-Akkumulator.[16]
EFB/AFB-Autobatterie
Eine EFB- (enhanced flooded battery) oder AFB-Batterie (advanced flooded battery) ist eine verbesserte Starterbatterie für Kraftfahrzeuge mit Verbrennungsmotoren.
Um die Emissionswerte durch automatische Motorabschaltung zu senken, werden Start-Stopp-Systeme mit EFB-Batterietechnik verwendet. Es ist eine Weiterentwicklung der herkömmlichen Nassbatterie (Akkumulator). Diese Batterien sind zyklenfester und rüttelfester und haben eine bessere Alterungsstabilität, eine bessere Ladungsaufnahme und thermische Stabilität als konventionelle Starterbatterien.[17] Sie sind günstiger als AGM-Batterien (engl.: AGM, absorbing glass mat) und werden dort eingesetzt, wo die Tiefentladeeigenschaften (deep cycle) einer AGM-Batterie nicht benötigt werden.[18] Ein weiterer Vorteil ist die längere Lagerfähigkeit dieser Batterie. Das kommt nicht nur den Händlern, sondern auch denjenigen Autofahrern zugute, die ihr Fahrzeug nur saisonal nutzen.[19]
Der Grundaufbau ist analog zu einer herkömmlichen Nassbatterie; Veränderungen in Details ergeben die verbesserten Eigenschaften: Die Zugabe von speziellen Kohlenstoffadditiven zum Blei reduziert die Sulfatbildung und verringert den inneren Widerstand. Die Batterie kann tiefer entladen werden und hat eine bessere Ladungsannahme, sie kann schneller aufgeladen werden und verfügt über eine höhere thermische Stabilität. Dies ermöglicht einen Einsatz in kalten sowie auch heißen Regionen.
Ein weiterer Unterschied liegt im Plattenaufbau. Die positiven Bleiplatten werden in ein spezielles Polyestergewebe sowie einen ionendurchlässigen Taschenseparator eingepackt. Die Plattensätze einer EFB-Batterie haben eine mittlere Kompression. Nach dem Auffüllen der EFB-Batterie mit flüssigem Elektrolyt saugt sich das Polyestergewebe damit voll und dehnt sich aus. Dadurch wird ein Druck auf die positiven Platten erzeugt, der dem aktiven Material zusätzliche Festigkeit verleiht.
Eine weitere Einsatzmöglichkeit findet sich in Fahrzeugen mit starken Vibrationen wie Traktoren, Geländefahrzeugen, Baufahrzeugen sowie Booten.
Verschlossene Bleiakkumulatoren
Bleiakkus können auch in einer verschlossenen Bauform hergestellt werden, die lageunabhängig betrieben werden können. Hierzu gehören die VRLA-Akkumulatoren. Die Säure wird dabei in Glasfasermatten (engl.: AGM, absorbing glass mat) oder als Gel in Kieselsäure gebunden. Ihr Vorteil besteht darin, dass beim vorschriftsmäßigen Laden in den Zellen nur wenig Knallgas entsteht und das Nachfüllen von destilliertem Wasser entfällt. Sollte durch Laden mit zu hoher Spannung zu schnell zu viel Gas entwickelt werden, öffnen sich Überdruckventile, bevor das Gehäuse platzt.
Auch beim vorschriftsmäßigen Laden entsteht etwas Knallgas, das an der negativen Elektrode zu Wasser rekombiniert. Ein Teil des Gases geht jedoch ungewollt durch Diffusion und Undichtigkeiten verloren. Deshalb trocknen VRLA-Akkumulatoren langsam aus. Sie sind nach 4 bis 5 Jahren in der Regel wegen des dadurch angestiegenen Innenwiderstands und geringer gewordener Kapazität unbrauchbar.
Stationäre Anwendung

Bleiakkumulatoren werden vorrangig als Pufferbatterien eingesetzt. Pufferbatterien unterstützen oder ersetzen bei Ausfall die Stromversorgung. Dabei spielen das hohe Gewicht und das Volumen nur eine untergeordnete Rolle. Anwendungsbeispiele:
- Unterbrechungsfreie Stromversorgung (USV) (Notstromversorgung, Alarmanlagen)
- zentrale Stromversorgungssysteme für Notbeleuchtung
- Solarbatterien in Photovoltaikanlagen (Inselanlagen)
In vielen Fällen werden Bleiakkumulatoren heute schon durch Lithium-Ionen-Akkumulatoren ersetzt. Der derzeit (2019) höhere Anschaffungspreis, meist 4-fach, wird oft durch die höhere Leistungsfähigkeit und Lebensdauer ausgeglichen, meist 15 Jahre.[20]
Mobile Anwendung

Bleiakkumulatoren werden in erster Linie als Starterbatterien, aber auch als Traktionsbatterien in Fahrzeugen verwendet. Starterbatterien liefern Strom zum Starten eines Verbrennungsmotors mit einem Anlasser und puffern ständig die Bordspannung. Sie liefern Strom beim Ausfall der Lichtmaschine und bei stehendem Motor. Traktionsbatterien liefern die Antriebsenergie für Fahrzeuge. Bei Gabelstaplern dienen Bleiakkumulatoren auch als Ausgleichsmasse (Gegengewicht) für die vor der Vorderachse aufgenommene Last. Bei Rollstühlen erhöht die tief eingebaute schwere Bleibatterie die Kippsicherheit.
Der Bleiakkumulator wird wegen seiner geringen massebezogenen Kapazität und Lebensdauer nach und nach durch andere Akkumulatorbauarten ersetzt werden.[21] So sind dezentrale oder mobile Anwendungen wegen der hohen Masse heute (2017) eher selten und beschränken sich auf wenige Anwendungen (zum Beispiel manche Staubsaugroboter sowie Weidezaungeräte). Demgegenüber stehen die Robustheit und die gute Kälteresistenz von Bleiakkumulatoren.

Anwendungsbeispiele:
- Starterbatterien (-Akku)für Fahrzeuge mit Verbrennungsmotor
- elektrische Rollstühle
- ältere bzw. preiswerte Elektrofahrräder
- ältere bzw. preiswerte Elektroroller
- ältere Elektroautos
- elektrische Gabelstapler
- U-Boote und Elektro-Torpedos
Wiederverwertung
Bleiakkumulatoren zeichnen sich durch ihren hohen Grad an Wiederverwertbarkeit aus. Mit Hilfe des 2009 eingeführten Pfandsystems für Starterbatterien werden in Deutschland beinahe 100 Prozent der Bleiakkumulatoren gesammelt und wiederverwertet.[22] Recycling-Blei kann nahezu ohne Qualitätsverlust beliebig oft zurückgewonnen werden.[23]
Literatur
- Chapter 16: Alvin Sakind, George Zuris: Lead-Acid Batteries. In: Thomas B. Reddy (Hrsg.): Linden's Handbook of Batteries. 4. Auflage. McGraw-Hill, New York 2011, ISBN 978-0-07-162421-3.
- Karl-Joachim Euler: Sinsteden – Planté – Tudor. Zur Geschichte des Bleiakkumulators. Gesamthochschule Kassel, Kassel 1980, OCLC 918271350.
- Heinz Wenzl: Batterietechnik / Optimierung der Anwendung – Betriebsführung – Systemintegration. Expert-Verlag, Renningen-Malmsheim 2002, ISBN 3-8169-1691-0.
- D. A. J. Rand, Patrick T. Moseley, Jurgen Garche, C. D. Parker: Valve-regulated Lead-Acid Batteries. Elsevier, 2004, ISBN 0-444-50746-9.
- Kapitel 2.1. Der Bleiakkumulator. In: Peter Birke, Michael Schiemann: Akkumulatoren: Vergangenheit, Gegenwart und Zukunft elektrochemischer Energiespeicher, H. Utz Verlag, München 2013, ISBN 978-3-8316-0958-1, S. 68–119.
- Chapter 8 Lead-Acid Batteries. In: Rand Dell: Understanding Batteries, Royal Society of Chemistry, 2001, ISBN 0-85404-605-4, S. 100–125.
Weblinks
- Thomas Rücker: Bleiakku-Interna: Wissenswertes über Bleiakkus für Interessierte. In: microcharge.de. Tom's Elektronikschmiede, archiviert vom (nicht mehr online verfügbar) am 3. Dezember 2017.
- Exide, Dezember 2008: Handbuch für stationäre Bleiakkumulatoren (PDF; 3,1 MB), 101 Seiten, 3. Auflage
- basytec, Andreas Jossen, Die Bleibatterie – Grundlagen, verschlossene Bauart, Alterung
- Varta-Batterielexikon (Memento vom 8. April 2006 im Internet Archive)
- Artikel über Bleiakkumulatoren auf elektronikinfo.de
Einzelnachweise
- Der Bleiakkumulator – Kapitel 2: Geschichte. Abgerufen am 21. Oktober 2009.
- Jos. A. Massard: 1886–1996, Hundertzehn Jahre elektrisches Licht in Echternach. (PDF; 13,6 MB) S. 9–10 (108–109 lt. Seitennummerierung), abgerufen am 21. Oktober 2009.
- Dagmar Wiechoczek: Der Bleiakkumulator. In: chemieunterricht.de: Technische Chemie im und ums Auto. Prof. Blumes Bildungsserver für Chemie, 17. November 1999, abgerufen am 15. September 2022.
- berechnet aus Datenblätter aktuell (Juli 2023) erhältlicher Markenakkus mit 10 bis 50 Ah
- berechnet aus Datenblätter aktuell (Juli 2023) erhältlicher Markenakkus mit 2 bis 2,7 Ah.
- Batterien, Ladekonzepte und Ladegeräte. EGSTON Holding GmbH, archiviert vom (nicht mehr online verfügbar) am 13. Dezember 2009; abgerufen am 31. Oktober 2009: „NiMH-Akku Energiedichte bis 90 Wh/kg“.
- Quelle: Datenblätter der Samsung 21700T und 21700E und Datenblätter von etlichen Traktions-Bleiakkus. Betriebstemperatur 20 °C
- D. Pavlov: Secondary Batteries – Lead–Acid Systems: Electrolyte. In: Jürgen Garche (Hrsg.): Encyclopedia of Electrochemical Power Sources. Band 4. Academic Press, Amsterdam 2009, ISBN 978-0-444-52745-5, S. 610–619; 617, doi:10.1016/B978-044452745-5.00133-7 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).
- Patent DE2357631A1: Katalytischer Oxidationsreaktor für Wasserstoff oder andere brennbare Gase in einem Sauerstoff enthaltenden Gasgemisch. Angemeldet am 19. November 1973, veröffentlicht am 28. Mai 1975, Anmelder: VARTA Batterie AG, Erfinder: Helmut Laig-Hoerstebrock, August D Winsel.
- Jens Tübke: Beschreibung Blei/Bleidioxid-System. In: Batterie-Glossar. Fraunhofer Institut für Chemische Technologie, abgerufen am 25. September 2022.
- Belüftung der Batterieladeräume für Antriebsbatterien. (PDF; 218 kB) Merkblatt. ZVEI – Fachverband Batterien, Oktober 2004, abgerufen am 2. September 2022 (Erfordernisse nach DIN EN 50272-3).
- Heinz-Albert Kiehne: Gerätebatterien. 3. Auflage. Expert Verlag, Renningen 2001, ISBN 3-8169-1470-5, S. 9 (eingeschränkte Vorschau in der Google-Buchsuche).
- Berechnungsgrundlagen Blei-Säure-Batterien. Valentin Software GmbH, 27. Oktober 2016, abgerufen am 29. September 2022.
- Rotek Bilder-Dienst: Diagramme Zyklenfestigkeit, Leerlaufspannungen bei Entladung, aufgerufen 23. März 2012.
- Heinz-Albert Kiehne: Gerätebatterien. 3. Auflage. Expert Verlag, Renningen 2001, ISBN 3-8169-1470-5, S. 54 (eingeschränkte Vorschau in der Google-Buchsuche).
- Akku-Grundlagen, Abschnitt Wirtschaftliche Betrachtung. RN-Wissen.de, abgerufen am 14. September 2014.
- Was ist der Unterschied zwischen AGM- und EFB-Autobatterien? In: automotive.at. Österreichischer Wirtschaftsverlag, 21. Dezember 2020, abgerufen am 2. September 2022.
- Deep Cycle Batterie. In: Campinglexikon. Fritz Berger GmbH, abgerufen am 2. September 2022.
- Alexander Beichert: Eine AGM-Vlies-Batterie hat viele Vorteile. In: Litzclip. 14. September 2018, abgerufen am 2. September 2022.
- Winston Battery: Intelligent Uninterruptible Energy Storage Cabinet (Memento des vom 19. Februar 2012 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.. Abgerufen am 8. März 2012.
- Winston Battery: WB-LP12V90AH, Datenblatt Blockakku 12V 90Ah LiFePO4 als Starterbatterie (Memento des vom 20. Oktober 2011 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.. Abgerufen am 8. März 2012.
- Autobatterie entsorgen: Wohin mit der alten Batterie? In: adac.de. 15. Januar 2021, abgerufen am 19. März 2021.
- Effektives Batterierecycling dank ausgefallener Logistik. In: umweltwirtschaft.com. 15. Januar 2021, abgerufen am 19. März 2021.