Blei(IV)-chlorid
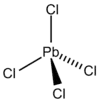
Blei(IV)-chlorid ist eine chemische Verbindung der Elemente Blei und Chlor. Die Substanz ist bei Raumtemperatur eine unbeständige, gelbe, ölige und an der Luft rauchende Flüssigkeit, die oberhalb von 50 °C zu Blei(II)-chlorid und Chlor zerfällt. Die PbCl4-Moleküle besitzen – analog zu organischen Verbindungen – eine tetraedrische Struktur.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||
| Allgemeines | ||||||||||
| Name | Blei(IV)-chlorid | |||||||||
| Summenformel | PbCl4 | |||||||||
| Kurzbeschreibung |
gelbe, ölige Flüssigkeit[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 349,012 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig | |||||||||
| Dichte |
3,18 g·cm−3 (bei 0 °C)[2] | |||||||||
| Schmelzpunkt |
−15 °C[1] | |||||||||
| Siedepunkt |
thermische Zersetzung: 50 °C[1] | |||||||||
| Löslichkeit |
in Wasser Hydrolyse[3] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Thermodynamische Eigenschaften | ||||||||||
| ΔHf0 | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
Blei(IV)-chlorid lässt sich durch Behandlung von Blei mit Chlorgas oder durch Umsetzung von Blei(IV)-oxid mit konzentrierter Salzsäure herstellen:[1]
Eine weitere Möglichkeit der Herstellung ist, umgekehrt zur Zersetzungsreaktion Blei(II)-chlorid mit Chlorgas umzusetzen. Dies gelingt allerdings nur über den Hexachlorokomplex. Daher wird zuerst in eine (eisgekühlte) Suspension von PbCl2 in konzentrierter Salzsäure Chlorgas eingeleitet und anschließend mit Ammoniumchlorid zitronengelbes Ammoniumhexachloroplumbat (NH4)2[PbCl6] ausgefällt. Durch Eintragen in konzentrierte Schwefelsäure scheidet sich PbCl4 ab, da dieses in Schwefelsäure unlöslich ist.[3]
Eigenschaften
Physikalische Eigenschaften
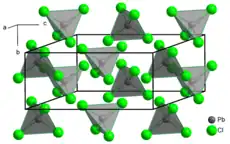 Kristallstruktur von PbCl4 bei 150 K | ||
| Kristallsystem | monoklin | |
| Raumgruppe | I2/a (Nr. 15, Stellung 7) | |
| Gitterparameter (Elementarzelle) | a = 1054,2 pm b = 535,9 pm c = 1195,8 pm | β = 115,83° |
| Zahl (Z) der Formeleinheiten |
Z = 4 | |
Chemische Eigenschaften
Bei Blei(IV)-chlorid handelt es sich, wie bei allen anderen Blei(IV)-Verbindungen, um ein starkes Oxidationsmittel.[1]
In Wasser hydrolysiert das Blei(IV)-chlorid rasch zu Blei(IV)-oxid und Chlorwasserstoff:[6]
In Verbindung mit wenig Wasser bildet sich ein Hydrat unbekannter Zusammensetzung; mit wenig kaltem Chlorwasserstoff erhält man eine feste, kristalline Hexachloroblei(IV)-säure H2[PbCl6].[8]
Oberhalb von 100 °C erfolgt ein explosionsartiger Zerfall unter Disproportionierung zu Blei(II)-chlorid und Chlor.[9]
Einzelnachweise
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1015–1016.
- Jean D’Ans, Ellen Lax, Roger Blachnik: Taschenbuch Für Chemiker und Physiker: Band 3: Elemente, Anorganische Verbindungen und Materialien, Minerale. 4. Auflage, Springer, 1998, ISBN 978-3-540-60035-0, S. 658.
- L. Kolditz: Anorganische Chemie, 2. Auflage, Deutscher Verlag der Wissenschaften, Berlin 1983, S. 406.
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag lead compounds with the exception of those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Bleiverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- Pradyot Patnaik: Handbook of inorganic chemicals. McGraw-Hill Professional, 2002, ISBN 978-0-07-049439-8, S. 480–481.
- I. J. Maley, S. Parsons, C. R. Pulham: Lead(IV) chloride at 150 K, in: Acta Crystallographica, 2002, Nr. E 58, S. i79–i81; doi:10.1107/S1600536802015064.
- H. T. Vulte: Laboratory Manual of Inorganic Preparations. Read Books, 2007, ISBN 978-1-4086-0840-1, S. 40.
- Bretherick’s Handbook of Reactive Chemical Hazards, edited by P.G. Urben, 6th Edition, Butterworth/Heinemann 1999, ISBN 0-7506-3605-X


