Phenylacetonitril
Phenylacetonitril ist eine bei Raumtemperatur als farblose (chem. rein, meist aber gelbliche) Flüssigkeit vorliegende, sehr giftige chemische Verbindung.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
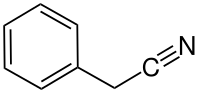 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Phenylacetonitril | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C8H7N | |||||||||||||||
| Kurzbeschreibung |
farblose ölige Flüssigkeit mit aromatischem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 117,15 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
1,02 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
234 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
schwer in Wasser (0,1 g·l−1 bei 20 °C)[2] | |||||||||||||||
| Brechungsindex |
1,5211 (25 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Vorkommen in der Natur

In der Natur findet sich Phenylacetonitril in Gartenkresse.[1][5]
Es ist außerdem im Sekret der Wüstenheuschrecke enthalten[1] und wirkt als Duftstoff (Pheromon).[6] Konkret wird es von Männchen in der gregären Phase mit Phenylalanin als Vorstufe gebildet, wobei es vor allem an Beinen und Flügeln sekretiert wird. Es dient als paarungsverhinderndes Pheromon.[7]
Darstellung
Phenylacetonitril 2 kann über Chlorierung von Toluol 1 zu Benzylchlorid und nachfolgende Umsetzung mit Natriumcyanid in Ethanol entsprechend der Kolbe-Nitrilsynthese synthetisiert werden.[8][9]

Verwendung
Phenylacetonitril wird als Zwischenprodukt in der chemischen Industrie verwendet und ist der Ausgangsstoff für die Herstellung von Phenylessigsäure.[10] Es dient auch als Riechstoff in der Parfum-Industrie.[11]
Einzelnachweise
- Eintrag zu Phenylacetonitril. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juni 2014.
- Eintrag zu Phenylacetonitril in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-32.
- Datenblatt Benzylcyanid bei Merck, abgerufen am 28. Januar 2018.
- Alexander J. Macleod, Rashida Islam: Volatile flavour components of garden cress. In: Journal of the Science of Food and Agriculture. Band 27, Nr. 10, Oktober 1976, S. 909–912, doi:10.1002/jsfa.2740271004.
- Ulrike Knoll: Verhaltensforschung: Duft-Spione. In: Spektrum.de, 17. Februar 2005, abgerufen am 28. Januar 2018.
- Karsten Seidelmann, Heike Weinert, Hans-Jörg Ferenz: Wings and legs are production sites for the desert locust courtship-inhibition pheromone, phenylacetonitrile. In: Journal of Insect Physiology. Band 49, Nr. 12, 1. Dezember 2003, S. 1125–1133, doi:10.1016/j.jinsphys.2003.08.005 (sciencedirect.com [abgerufen am 9. Mai 2023]).
- S. Hauptmann, J. Gräfe, H. Remane: Lehrbuch der organischen Chemie, Deutscher Verlag der Grundstoffindustrie Leipzig 1980, S. 378.
- Roger Adams, A. F. Thal: Benzyl Cyanide In: Organic Syntheses. 2, 1922, S. 9, doi:10.15227/orgsyn.002.0009; Coll. Vol. 1, 1941, S. 107 (PDF).
- Haiyang Fan, Lifeng Chen, Huihui Sun, Hualei Wang, Qinghai Liu, Yuhong Ren, Dongzhi Wei: Development of nitrilase-mediated process for phenylacetic acid production from phenylacetonitrile. In: Chemical Papers. Band 71, Nr. 10, Oktober 2017, S. 1985–1992, doi:10.1007/s11696-017-0192-x.
- David R Bickers, Peter Calow, Helmut A Greim, Jon M Hanifin, Adrianne E Rogers, Jean-Hilaire Saurat, I Glenn Sipes, Robert L Smith, Hachiro Tagami: The safety assessment of fragrance materials. In: Regulatory Toxicology and Pharmacology. Band 37, Nr. 2, 1. April 2003, S. 218–273, doi:10.1016/S0273-2300(03)00003-5 (sciencedirect.com [abgerufen am 9. Mai 2023]).
