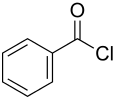
Benzoylchlorid
Benzoylchlorid ist eine chemische Verbindung aus der Stoffgruppe der Carbonsäurechloride. Es handelt sich um das Säurechlorid der Benzoesäure.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Benzoylchlorid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C7H5ClO | ||||||||||||||||||
| Kurzbeschreibung |
farblose, an feuchter Luft rauchende, tränenreizende Flüssigkeit mit stechendem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 140,57 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,22 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
197 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
Zersetzung in Wasser[2] | ||||||||||||||||||
| Brechungsindex |
1,5537 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
nicht festgelegt, da Verdacht auf krebserzeugende Wirkung[2] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
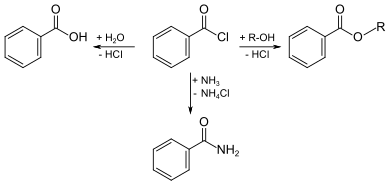
Benzoylchlorid lässt sich durch die Umsetzung von Benzoesäure mit Thionylchlorid oder Phosphortrichlorid synthetisieren.[5]
Wichtigste Methoden der industriellen Herstellung des Benzoylchlorids sind jedoch die Chlorierung von Benzaldehyd:
sowie die kontrollierte Hydrolyse von Benzotrichlorid:
oder dessen Reaktion mit Benzoesäure:
Eigenschaften
Benzoylchlorid ist eine schwer entzündliche, farblose Flüssigkeit (Flammpunkt zwischen 55 und 100 °C), deren Dämpfe mit Luft beim Erhitzen des Stoffes über seinen Flammpunkt ein explosionsfähiges Gemisch bilden können. An feuchter Luft ist die Chemikalie infolge der Zersetzung zu Chlorwasserstoff und Benzoesäure leicht rauchend.
Reaktionen
Benzoylchlorid reagiert mit Wasser in einer Hydrolysereaktion zu Benzoesäure und Salzsäure. Durch Reaktion mit Ammoniak lässt sich Benzamid herstellen und durch die Umsetzung mit Alkoholen sind die entsprechenden Benzoesäureester zugänglich.
Verwendung
Benzoylchlorid wird u. a. zur Herstellung von Benzoesäureestern verwendet. Wegen seiner Schwerlöslichkeit in Wasser kann die Veresterung gut nach der Schotten-Baumann-Methode durchgeführt werden. Die Verwendung von Carbonsäurechloriden anstelle der Carbonsäuren liefert deutlich höhere Ausbeuten.
In der Nucleinsäurenchemie dient Benzoylchlorid in Pyridin als Lösungsmittel als beliebtes Reagens zur Einführung der Benzoyl-Schutzgruppe, um sekundäre Alkohole zu schützen. Die Schutzgruppe kann durch alkalische Hydrolyse des Benzoesäureesters leicht wieder entfernt werden.[6]
Sicherheitshinweise
Beim Kontakt mit Wasser (z. B. aus der Luft) entstehen gefährliche Chlorwasserstoff-Dämpfe. Benzoylchlorid verursacht auf der Haut schmerzhafte Verätzungen. Die unangenehm und stechend riechenden Dämpfe reizen Atemwege und Augen. Im Tierversuch erwies sich Benzoylchlorid (wahrscheinlich wegen der extrem schnellen Metabolisierung zu Benzoesäure, Hippursäure und Chlorwasserstoff) nicht als genotoxisch. Aussagen zur Kanzerogenität können zurzeit nicht getroffen werden.[7]
Einzelnachweise
- Eintrag zu BENZOYL CHLORIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 24. Oktober 2021.
- Eintrag zu Benzoylchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-40.
- Eintrag zu Benzoyl chloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Klaus Schwetlick u. a.: Organikum. 21. Auflage. Wiley-VCH, Weinheim 2001, ISBN 3-527-29985-8, S. 498.
- Daniel Krois: Organisch-chemische Methoden. Springer-Verlag, 2016, ISBN 978-3-662-53013-9, S. 63 (eingeschränkte Vorschau in der Google-Buchsuche).
- BAUA (Memento vom 27. September 2007 im Internet Archive)


.svg.png.webp)
.svg.png.webp)
.svg.png.webp)
.svg.png.webp)