Benzotrifluorid
Benzotrifluorid ist eine chemische Verbindung aus der Gruppe der aromatischen Fluorkohlenwasserstoffe. Es ist eine farblose, flüchtige, leichtentzündliche und fast geruchlose Flüssigkeit.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
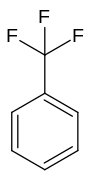 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Benzotrifluorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H5F3 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, leichtentzündliche, fast geruchlose Flüssigkeit[1][2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 146,11 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,2 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
102 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
sehr schwer in Wasser (0,45 g·l−1 bei 20 °C, Hydrolyse)[2] | ||||||||||||||||||
| Brechungsindex |
1,413–1,415[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
Benzotrifluorid kann durch Fluorierung (zum Beispiel durch Antimon(III)-fluorid oder Fluorwasserstoff) von Benzotrichlorid hergestellt werden.[5][6]
Eigenschaften
Physikalische Eigenschaften
Benzotrifluorid ist eine farblose, leichtentzündliche, fast geruchlose Flüssigkeit, welche sehr schlecht löslich in Wasser ist.[2] Der Siedepunkt unter Normaldruck beträgt 102,3 °C.[7] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in Torr, T in K) mit A = 6,642, B = 1148,7 und C = −70,9 im Temperaturbereich von 2 bis 80 °C.[7] Die Verbindung hat einen Heizwert von 4,6 kWh/kg.[8] Die Dämpfe von Benzotrifluorid sind fünfmal so schwer wie Luft.
Sie reagiert mit heißem Wasser, wobei sich Fluorwasserstoff und Benzoesäure bilden. Seine Polarität liegt zwischen der von Dichlormethan und Ethylacetat. Es ist mit den üblichen organischen Lösungsmitteln mischbar und in der Lage, viele organische Verbindungen zu lösen.[9]
Verwendung
Benzotrifluorid dient als Ausgangsstoff zur Herstellung von Herbiziden, Farbstoffen und Pharmazeutika, wie zum Beispiel dem Zwischenprodukt m-Chlorbenzotrifluorid C7H4ClF3 und Benzotrifluoridisocyanaten.[10] Es wird in einer Vielzahl von Reaktionen eingesetzt, darunter Radikalreaktionen, Oxidationen und Reduktionen, Phasentransferreaktionen, durch Übergangsmetalle katalysierte Prozesse und Lewis-Säure-Reaktionen.[9] Es wird weiterhin als Lösungsmittel eingesetzt.[11]
Sicherheitshinweise
Benzotrifluoriddämpfe bilden mit Luft ein explosionsfähiges Gemisch (Flammpunkt 12 °C, Zündtemperatur 620 °C).[2]
Einzelnachweise
- Datenblatt Benzotrifluorid bei Merck, abgerufen am 27. Februar 2010.
- Eintrag zu alpha,alpha,alpha-Trifluortoluol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- Eintrag zu Benzotrifluorid bei ChemBlink, abgerufen am 25. Februar 2011.
- Eintrag zu α,α,α-trifluorotoluene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- J. H. Simons, C. J. Lewis: The Preparation of Benzotrifluoride. In: Journal of the American Chemical Society. Band 60, Nr. 2, 1938, S. 492–492, doi:10.1021/ja01269a507.
- Patent EP0004636B1: Verfahren zur Darstellung von Benzotrifluorid und seinen Derivaten. Angemeldet am 28. März 1979, veröffentlicht am 7. Juli 1982, Anmelder: Daikin Kogyo Co Ltd, Erfinder: Yohnosuke Ohsaka.
- Field, F.H.; Saylor, J.H.: The Vapor Pressures of Some Organic Fluorides in J. Am. Chem. Soc. 68 (1946) 2649–2650.
- Heizwerte. In: bauforumstahl.de. Abgerufen am 25. März 2023. (PDF; 15 kB)
- Carlos A. M. Afonso, João Pedro G. Crespo: Green Separation Processes: Fundamentals and Applications. John Wiley & Sons, 2006, ISBN 978-3-527-60681-8, S. 221 (books.google.com).
- Paul Knochel: Modern Solvents in Organic Synthesis. Springer, 2003, ISBN 978-3-540-48664-0, S. 79 (books.google.com).
- Akiya Ogawa, Dennis P. Curran: Benzotrifluoride: A Useful Alternative Solvent for Organic Reactions Currently Conducted in Dichloromethane and Related Solvents. In: The Journal of Organic Chemistry. Band 62, Nr. 3, 1997, S. 450–451, doi:10.1021/jo9620324.

