Kristallviolett
Kristallviolett (nach dem botanischen Namen des Enzians auch Gentianaviolett beziehungsweise Enzianviolett genannt, nach dem Colour Index C.I. Basic Violet 3) ist ein violetter kationischer Triphenylmethanfarbstoff mit der Summenformel C25H30N3Cl. Der Name bezieht sich auf die Farbe, die den Blütenblättern bestimmter Enzianarten ähnelt, es wird jedoch nicht aus Enzian oder Veilchen gewonnen. In festem Zustand hat es einen goldgrünen, metallischen Glanz, in Wasser gelöst erscheint es dunkelviolett. Kristallviolett wurde erstmals 1883 hergestellt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Kristallviolett | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C25H30ClN3 | |||||||||||||||||||||
| Kurzbeschreibung |
grüner, geruchloser Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 407,99 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Dichte |
1,19 g·cm−3 (20 °C)[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
wenig in Wasser (10 g·l−1 bei 20 °C)[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: krebserzeugend (CMR)[3] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Es wird unter anderem für das Färben von Textilien, in Druckfarben und als histologisches Färbemittel und in der Gram-Methode zur Klassifizierung von Bakterien verwendet. Kristallviolett besitzt antibakterielle, antimykotische und anthelmintische, wurmtötende Eigenschaften und war früher als topisches Antiseptikum von Bedeutung. Die medizinische Verwendung des Farbstoffs wurde durch modernere Arzneimittel weitgehend verdrängt.
Geschichte

Kristallviolett fiel zunächst als einer der Bestandteile von Methylviolett an, einem Farbstoff, der erstmals 1861 von Charles Lauth synthetisiert wurde.[4] Dabei handelte es sich um ein Gemisch aus tetra-, penta- und hexamethylierten Pararosanilinen.[5] Ab 1866 wurde Methylviolett von der Firma Poirrier et Chappat in Saint-Denis hergestellt und unter dem Namen „Violet de Paris“ vermarktet.
Reines Kristallviolett wurde erstmals 1883 von Alfred Kern synthetisiert, der in Basel bei der Firma Bindschedler & Busch arbeitete.[6] Um die schwierige Synthese mit Phosgen zu optimieren, arbeitete Kern mit dem deutschen Chemiker Heinrich Caro bei der BASF zusammen.[7] Kern entdeckte auch, dass er den eng verwandten violetten Farbstoff, der heute als C.I. 42600 oder C.I. Basic Violet 4 bekannt ist, synthetisieren konnte, wenn er mit N,N-Diethylanilin statt mit N,N-Dimethylanilin begann.
Der Name „Enzianviolett“ wurde wahrscheinlich von dem deutschen Apotheker Georg Grübler eingeführt, der 1880 in Leipzig eine Firma gründete, die sich auf den Vertrieb von Färbereagenzien für die Histologie spezialisierte.[8] Die von Grübler vertriebene Enzianviolettfärbung enthielt wahrscheinlich eine Mischung aus methylierten Pararosanilinfarbstoffen.[9] Die Färbung erwies sich als populär und wurde 1884 von Hans Christian Gram zum Färben von Bakterien verwendet. Er schrieb die Anilin-Enzianviolett-Mischung Paul Ehrlich zu. Grüblers Enzianviolett war wahrscheinlich sehr ähnlich, wenn nicht identisch, mit dem Methylviolett von Lauth, das 1875 von Victor André Cornil als Färbemittel verwendet wurde.
Obwohl der Name Enzianviolett weiterhin für histologische Färbungen verwendet wurde, fand er in der Farbstoff- und Textilindustrie keine Verwendung. Die Zusammensetzung des Farbstoffes war nicht definiert und verschiedene Lieferanten verwendeten unterschiedliche Mischungen. 1922 setzte die Biological Stain Commission ein Komitee unter dem Vorsitz von Harold Conn ein, um die Eignung der verschiedenen kommerziellen Produkte zu untersuchen.[10] In seinem Buch „Biological Stains“ beschreibt Conn Enzianviolett als „eine schlecht definierte Mischung violetter Rosaniline“.
Die Entdeckung der antiseptischen Eigenschaften von Enzianviolett wird dem deutschen Augenarzt Jakob Stilling zugeschrieben. Er veröffentlichte 1890 eine Monographie über die bakterizide Wirkung einer Lösung, die er „Pyoktanin“ nannte und bei der es sich wahrscheinlich um eine dem Enzianviolett ähnliche Mischung von Anilinfarbstoffen handelte.[11] Er ging eine Partnerschaft mit E. Merck & Co. ein, um „Pyoktanin caeruleum“ als Antiseptikum zu vermarkten.
Carl Benda wies 1898 durch Färbung mit Kristallviolett Hunderte von Körnchen im Cytoplasma eukaryotischer Zellen nach und nannte sie Mitochondrien, von griechisch mitos, Faden, und khondrion, Körnchen.[12]
Im Jahr 1902 stellten Wilhelm von Drigalski und Heinrich Conradi fest, dass Kristallviolett zwar das Wachstum vieler Bakterien hemmt, aber nur eine geringe Wirkung auf Bacillus coli (Escherichia coli) und Bacillus typhi (Salmonella typhi), beides gramnegative Bakterien, hat.[13] Eine sehr viel detailliertere Studie über die Wirkung von Grüblers Enzianviolett auf verschiedene Bakterienstämme wurde 1912 von John Churchman veröffentlicht. Er stellte fest, dass die meisten grampositiven (angefärbten) Bakterien empfindlich auf den Farbstoff reagierten, während die meisten gramnegativen (nicht angefärbten) Bakterien unempfindlich waren, und beobachtete, dass der Farbstoff eher bakteriostatisch als bakterizid wirkt.
Gewinnung und Darstellung
Kristallviolett wird durch Kondensation von Michlers Keton (4,4′-Bis-dimethylamino-benzophenon) (1) mit N,N-Dimethylanilin (2) in Gegenwart von Phosphorylchlorid erhalten. Dabei findet eine elektrophile Substitution am N,N-Dimethylanilin in para-Stellung durch den Kohlenstoff der Carbonylgruppe von Michlers Keton statt. Phosphorylchlorid dient als Elektronenpaarakzeptor für den Sauerstoff der Carbonylgruppe des Ketons. Das Kohlenstoffatom ist dadurch positiv geladen und damit in der Lage, den Aromaten elektrophil anzugreifen. Aus der entstehenden Carbinolbase (3) wird anschließend Wasser eliminiert.[7]
.svg.png.webp)
Michlers Keton lässt sich durch die Umsetzung von N,N-Dimethylanilin mit Phosgen unter Lewis-Katalyse beispielsweise mit Zinkchlorid darstellen. Mit einem Überschuss N,N-Dimethylanilin wird unter diesen Bedingungen direkt, ohne Isolierung von Michlers Keton, Kristallviolett gebildet.[14]
Eine weitere Darstellung erfolgt über die Reaktion von N,N-Dimethylanilin (1) mit Formaldehyd (2). Es entsteht zunächst die Michlers Base (3) die mit Blei(IV)-oxid zu dem Benzhydrol-Derivat (4) oxidiert wird. Dieses kondensiert mit N,N-Dimethylanilin zum Leuko-Kristallviolett (5). Durch die Oxidation mit einem Oxidationsmittel wie Mangandioxid in Gegenwart von Salzsäure entsteht Kristallviolett (6).[14]
.svg.png.webp)
Kristallviolett wird in Indien, China und in gewissem Umfang in den USA hergestellt. Die Produktionsmengen in China und Indien sind nicht bekannt, in den USA wurden 1986 und 1990 Produktionsmengen von Kristallviolett zwischen 227 und 454 Tonnen pro Jahr angegeben. Kristallviolett wird in der Europäischen Union nicht hergestellt, aber die EU importierte zwischen 210 und 230 Tonnen Kristallviolett im Jahr 2012.[15]
Eigenschaften

Kristallviolett liegt meist in Form feiner, metallisch-gold glänzender Nadeln vor. Es löst sich in Wasser und anderen polaren Lösungsmitteln mit intensiv violetter Farbe mit einem Absorptionsmaximum bei 590 Nanometern.[16] Das Absorptionsspektrum zeigt neben den Absorptionsmaxima eine Schulterbande. Diese Besonderheit des Absorptionsspektrums wird durch die Existenz zweier Grundzustandsisomere erklärt, die planare und die pyramidale Form.[17] Aus der Kristallstrukturanalyse geht hervor, dass Kristallviolett im festen Zustand eine propellerartige Struktur aufweist, bei der die aromatischen Ringe um 32 ° gegenüber der zentralen horizontalen Ebene gedreht sind.[18]
- Kristallviolett als Feststoff und in wässriger Lösung
 Kristallviolett-Nadeln mit gold-grünlichem, metallischem Glanz
Kristallviolett-Nadeln mit gold-grünlichem, metallischem Glanz Wässrige Lösung von Kristallviolett
Wässrige Lösung von Kristallviolett
Kristallviolett färbt Naturfasern leuchtend violett, ist jedoch verhältnismäßig leicht auswaschbar. Bei Zugabe von starken Säuren zur wässrigen Lösung durchläuft Kristallviolett eine Reihe von Farbumwandlungen. Es wird als pH-Indikator bei der wasserfreien Gehaltsbestimmung von schwachen Basen eingesetzt. Säuert man eine Lösung von Kristallviolett leicht an, erfolgt ein Farbumschlag von Violett nach Grün, weil das Auxochrom des dritten Kernes seine elektronenliefernde Fähigkeit und damit seine Farbrelevanz durch Addition eines Protons verliert. Ein stärkeres Ansäuern führt zu einer gelben Verbindung, bei der ein weiteres Auxochrom durch Protonierung deaktiviert wird. Die verschiedenen Farben ergeben sich aus den unterschiedlichen Ladungszuständen des Farbstoffmoleküls.
In der gelben Form tragen alle drei Stickstoffatome eine positive Ladung, von denen zwei protoniert sind, während die grüne Farbe einer Form des Farbstoffs entspricht, in der zwei der Stickstoffatome positiv geladen sind. Bei neutralem pH-Wert gehen die beiden zusätzlichen Protonen an die Lösung verloren, so dass nur noch eines der Stickstoffatome positiv geladen ist. Die pKa für den Verlust der beiden Protonen betragen etwa 1,15 und 1,8.[16]

Gibt man zu einer stark verdünnten Kristallviolettlösung Natronlauge, so entfärbt sich die Lösung langsam. Hierbei lagert sich ein Hydroxidion an das in einer mesomeren Grenzform im Zentrum des Moleküls gebildete Carbeniumion, die sogenannte Pseudobase des Kristallvioletts. Diese Reaktion lässt sich reaktionskinetisch mit einem Photometer untersuchen. Wenn die Konzentration des Kristallvioletts viel kleiner ist als die Konzentration der Natronlauge läuft die Reaktion pseudo-erster Ordnung ab.[19]
Bei der Färbermethode nach Gram werden Bakterien mit Kristallviolett angefärbt und anschließend mit Iod-Kaliumiodid-Lösung versetzt, wodurch ein Iod-Kaliumiodid-Farbstoff-Charge-Transfer-Komplex entsteht.[20]
Verwendung
Kristallviolett findet Verwendung als Farbstoff in Farbbändern, Lacken, Druckfarben, in Kopierstiften und in der mikroskopischen Färbetechnik als Hauptbestandteil der Gram-Färbung, mit deren Hilfe sich Bakterien in zwei Klassen einteilen lassen. Weiterhin wird es beim Plaque-Assay eingesetzt und gelegentlich auch im Probenpuffer für eine Agarose-Gelelektrophorese von DNA, wenn eine Gelextraktion folgt. Es wird als Purpurfarbstoff für Textilien wie Baumwolle, Seide und Nylon verwendet. Kristallviolett wird auch zum Färben von mit Polyacrylnitril modifiziertem Nylon und Wolle sowie zum Färben von Kunststoffen, Fetten, Ölen und Wachsen verwendet.[21]
Histologische Färbung

Bei der Färbung nach Gram dissoziiert Kristallviolett in wässriger Lösung und die entstehenden Ionen durchdringen die Zellwand und die Membran sowohl grampositiver als auch gramnegativer Bakterienzellen, die aber eine verschieden dicke Peptidoglycanschicht in der Zellwand aufweisen. Das Kristallviolett-Kation reagiert mit negativ geladenen Bestandteilen der Bakterienzelle und färbt diese violett. Durch Zugabe von Iod bilden sich im Zytoplasma und in den äußeren Zellschichten Charge-Transfer-Komplexe.[22]
Bei der Färbung nach Neisser handelt es sich um einen Test auf das Vorhandensein von in den Zellen gespeicherten Polyphosphaten mit einer Mischung aus Kristallviolett, Methylenblau und Chrysoidin-Y. Zudem können damit die für die biologische Phosphorelimination verantwortlichen Bakterien sichtbar gemacht werden.[23]
Medizinische Verwendung
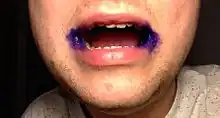
Medizinisch wurde Kristallviolett lange Zeit, bis zur Entdeckung anderer wirksamer Antimykotika, zur Behandlung von Hautpilzerkrankungen (Mykosen), insbesondere Fußpilzen, sowie von Mundsoor und Mundwinkelentzündung verwendet. Dazu wird es als Pyoktaninlösung (0,5–2 %) aufgepinselt. In der westlichen Welt wird es heute wegen der Einfärbung der Haut fast nur noch in der Naturheilkunde verwendet. In der pädiatrischen Dermatologie findet es noch Anwendung bei Herden des atopischen Ekzems, wenn dieses durch grampositive Bakterien oder Dermatophyten ausgelöst wird. Nach Empfehlungen der WHO war Kristallviolett bis ins Jahr 2011 als essenzielles Medikament einzustufen.[24]
Intravenös wird es eingesetzt zur Therapie von sekundären Lungenmykosen. Die fungistatische Wirkung von Kristallviolett ist, je nach Mykosenart, um den Faktor 10 bis 100 stärker als die des stark verbreiteten Clotrimazol. Übertroffen wird es von Amphotericin B, das jedoch im Vergleich stark toxisch ist. Daher wird Kristallviolett häufig bei immungeschwächten Patienten eingesetzt.
Tiermedizinische Verwendung
In den 1930er Jahren wurde ein Schweinepest-Impfstoff aus dem von Fibrinogen befreitem Blut von mit Schweinepest infizierten Tieren und Kristallviolett hergestellt. Die Sicherheit und Wirksamkeit dieses Impfstoffs war jedoch gering.[25] Der Impfstoff wurde bis in die 1970er Jahre benutzt.[26]
Toxikologie
Kristallviolett darf nicht ins Auge gelangen, da es dort schwere Schäden verursachen kann. Ferner ist bei äußerlicher Anwendung eine Überdosierung zu vermeiden, da Kristallviolett, ebenso wie die verwandten und ähnlich verwendeten Triphenylmethanfarbstoffe Malachitgrün und Brilliantgrün, zelltoxisch auf die Haut wirkt.
Im Juni 2019 warnte die kanadische Gesundheitsbehörde Health Canada vor einer möglichen Krebsgefährdung durch Kristallviolett und empfahl, Anwendungen auch in der Tiermedizin zu stoppen.[27] Seit November 2020 ist Kristallviolett in der Europäischen Union wegen seines krebserregenden Potentials über REACH Anhang XVII auf eine Konzentration von 50 mg/kg in einem homogenen Material begrenzt.[28]
Über den Safe Drinking Water and Toxic Enforcement Act of 1986 besteht in Kalifornien seit 23. November 2018 eine Kennzeichnungspflicht, wenn Kristallviolett in einem Produkt enthalten ist.[29]
Umweltrelevanz
Während der Herstellung und Verarbeitung gehen schätzungsweise 12 % der synthetischen Farbstoffe verloren. Wasser wird in jeder Phase der Textilverarbeitung verwendet, beispielsweise bei der Nassveredelung, beim Übertragen von Chemikalien auf Textilien und beim Waschen. Dies hat zur Folge, dass große Mengen gefärbten Abwassers anfallen. Wenn Kristallviolett ungeklärt in aquatischen Ökosysteme gelangt, beeinträchtigt es die photosynthetische Aktivität der Wasserpflanzen, was zu einer Verringerung des Gehalts an gelöstem Sauerstoff führt und somit letztlich den normalen Lebensprozess der Wasserflora und -fauna stört.[21] Für die Entfernung von Kristallviolett aus Abwasser wurden daher verschiedene physikalische, chemische und biologische Methoden vorgeschlagen. Zu den physikalischen Methoden zählen die Adsorption an modifizierten Chitosanen, Lignin und Nanocellulose.[30][31][32]
Als chemische Behandlungsmethoden wurden System auf Basis der Fenton-Reaktion getestet.[33] Daneben wurden photochemische Methoden sowie die Ozonierung eingesetzt.[21] Kristallviolett wurde mit Hilfe eines Systems von manganoxidierenden Bakterien aus Bacillus sp. und Sphingobacterium sp. vollständig entfärbt.[34] Neben Bakterien wurden Aabbaumechanismen über Hefen und Pilze getestet.[21]
Literatur
- S. Mani, R.N. Bharagava: Exposure to Crystal Violet, Its Toxic, Genotoxic and Carcinogenic Effects on Environment and Its Degradation and Detoxification for Environmental Safety. In: P. de Voogt (Hrsg.): Reviews of Environmental Contamination and Toxicology. Springer International Publishing, Schweiz, 2016, Bd. 237, Reviews of Environmental Contamination and Toxicology 237, doi:10.1007/978-3-319-23573-8_4.
- Dean Thetford: Triphenylmethane and related Dyes. In: Kirk-Othmer Encyclopedia of Chemical Technology, Wiley, 2001, doi:10.1002/0471238961.2018091620080520.a01.pub2, S. 1–21.
Weblinks
Einzelnachweise
- Eintrag zu Kristallviolett in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Eintrag zu [4-[4,4′-bis(dimethylamino)benzhydrylidene]cyclohexa-2,5-dien-1-ylidene]dimethylammonium chloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 18. Oktober 2015.
- C. Lauth: On the new aniline dye, Violet de Paris. In: Laboratory. 1, 1867, S. 138–139.
- W. M. Gardner: The British coal-tar industry: its origin, development, and decline. Lippincott, Philadelphia, (Online).
- Patent US290856A: Manufacture of dye-stuff. Veröffentlicht am 25. Dezember 1883, Erfinder: H. Caro, A. Kern.
- C. Reinhardt, A. S. Travis: Heinrich Caro and the creation of modern chemical industry. Kluwer Academic, Dordrecht, 2000, ISBN 0-7923-6602-6,s.&nbp;208–209.
- M. Titford: George Grubler and Karl Hollborn: Two Founders of the Biological Stain Industry. In: Journal of Histotechnology. 16.2, 1993, S. 155–158, doi:10.1179/his.1993.16.2.155.
- M. Titford: Comparison of historic Grübler dyes with modern counterparts using thin layer chromatography. In: Biotechnic and Histochemistry. 82.4–5, 2007, S. 227–234, doi:10.1080/10520290701714005.
- H. J. Conn: An Investigation of American Gentian Violets Report of Committee on Bacteriological Technic. In: Journal of Bacteriology. 7.5, 1922, S. 529–536, doi:10.1128/jb.7.5.529-536.1922.
- J. Stilling: Anilin Farbstoffe als Antiseptica und ihre Anwendung in der Praxis. 1890.
- Paulo N. Correa, Alexandra N. Correa: Wilhelm Reich's Claim of the Heterogenesis of Eukaryotic Amoebae. In: Journal of Biophysics, Hematology and Oncology. 1.1, 2010, S. 1–17, (online).
- W. von Drigalski, H. Conradi: Ueber ein Verfahren zum Nachweis der Typhusbacillen. In: Zeitschrift für Hygiene und Infektionskrankheiten. 39.1, 1902, S. 283–300, doi:10.1007/bf02140310.
- Dean Thetford: Kirk-Othmer Encyclopedia of Chemical Technology. 1. Auflage. Wiley, 2001, doi:10.1002/0471238961.2018091620080520.a01.pub2.
- IARC Working Group on the Identification of Carcinogenic Hazards to Humans: Gentian Violet, Leucogentian Violet, Malachite Green, Leucomalachite Green, and CI Direct Blue 218. IARC Monographs on the Identification of Carcinogenic Hazards to Humans, No. 129, 2022, ISBN 978-92-832-0169-4 (online).
- E. Q. Adams, Ludwig Rosenstein: The Color and Ionization of Crystal Violet. In: Journal of the American Chemical Society. 36.7, 1914, S. 1452–1473, doi:10.1021/ja02184a014.
- G. N. Lewis, T. T. Magel, D. Lipkin: Isomers of Crystal Violet Ion. Their Absorption and Re-emission of Light. In: Journal of the American Chemical Society. 64.8, 1942, S. 1774–1782, doi:10.1021/ja01260a009.
- P. Sharma, N. Sohal, B. Maity: Encapsulation and release of non-fluorescent crystal violet confined in bile-salt aggregates. In: RSC Advances. 11.18, 2021, S. 10912–10921, doi:10.1039/d0ra06599d.
- Michael Binnewies u. a.: Geschwindigkeit chemischer Reaktionen. In: Allgemeine und Anorganische Chemie. Springer Spektrum, Berlin, Heidelberg, 2016, doi:10.1007/978-3-662-45067-3_13, S. 353–372.
- G. J. Hucker, H. J. Conn: Methods of Gram Staining. New York Agricultural Experiment Station. Technical Bulletin No. 93. The Station, Geneva, N.Y., 1923. (online).
- S. Mani, R.N. Bharagava: Exposure to Crystal Violet, Its Toxic, Genotoxic and Carcinogenic Effects on Environment and Its Degradation and Detoxification for Environmental Safety. In: P. de Voogt (Hrsg.): Reviews of Environmental Contamination and Toxicology. Springer International Publishing, Schweiz, 2016, Reviews of Environmental Contamination and Toxicology, Band 237, doi:10.1007/978-3-319-23573-8_4.
- A. A. Paray, M. Singh, M. Mir: Gram Staining: A Brief Review. In: International Journal of Research and Review. 10.9, 2023, S. 336–341, doi:10.52403/ijrr.20230934.
- Dick H. Eikelboom: Process Control of Activated Sludge Plants by Microscopic Investigation. IWA Publishing, 2000, ISBN 978-1-900222-29-7, S. 15–18.
- WHO Model Lists of Essential Medicines, März 2007, Rubrik 13.2 (englisch: PDF; 379 kB)
- S. Blome, C. Moß, I. Reimann, P. König, M. Beer: Classical swine fever vaccines—State-of-the-art. In: Veterinary Microbiology. 206, 2017, S. 10–20, doi:10.1016/j.vetmic.2017.01.001.
- A. J. de Smit: Laboratory diagnosis, epizootiology, and efficacy of marker vaccines in classical swine fever: A review. In: Veterinary Quarterly. 22.4, 2000, S. 182–188, doi:10.1080/01652176.2000.9695054.
- Health Canada warns Canadians of potential cancer risk associated with gentian violet - Canada.ca. In: recalls-rappels.canada.ca. 12. Juni 2019, abgerufen am 2. April 2024 (englisch).
- Verordnung (EU) 2018/1513 (PDF)
- Gentian Violet. OEHHA, 23. November 2018, abgerufen am 1. Juni 2022 (englisch).
- Asitha T. Cooray, Kavindya Weerasinghe, Samantha Ranaweera: Applications of Chitosan-and Chitin-Based Biomaterials in Cationic Dye Removal. In: Subramanian Senthilkannan Muthu, Ali Khadir (Hrsg.): Textile Wastewater Treatment. Sustainable Bio-nano Materials and Macromolecules. Band 1, Springer Nature, Singapore, 2022, ISBN 978-981-19-2831-4, S, 36.
- Md. Din Islam, M. K. Mohammad Ziaul Hyder, Md. Masudur Rhaman, Sajjad Husain Mir: Application of Lignin-Based Biomaterials in Textile Wastewater. In: Subramanian Senthilkannan Muthu, Ali Khadir (Hrsg.): Textile Wastewater Treatment. Sustainable Bio-nano Materials and Macromolecules. Band 1, Springer Nature, Singapore, 2022, ISBN 978-981-19-2831-4, S, 82–87.
- Swarnalatha Venkatanarasimhan, D. Gangadharan, Thilagavathy Palanisamy: Cellulose Nanocrystal as a New Promising Candidate in Textile Wastewater Treatment. In: Subramanian Senthilkannan Muthu, Ali Khadir (Hrsg.): Textile Wastewater Treatment. Sustainable Bio-nano Materials and Macromolecules. Band 1, Springer Nature, Singapore, 2022, ISBN 978-981-19-2831-4, S, 125.
- F. Rehman u. a.: Degradation of Crystal Violet Dye by Fenton and Photo-Fenton Oxidation Processes. In: Zeitschrift für Physikalische Chemie. 232.12, 2018, S. 1771–1786, doi:10.1515/zpch-2017-1099.
- D. Bharathi u. a.: Microbial approaches for sustainable remediation of dye-contaminated wastewater: a review. In: Archives of Microbiology. 204.3, 2022, S. 1–11, doi:10.1007/s00203-022-02767-3.



