Bariumcarbonat
Bariumcarbonat ist das Carbonat des Erdalkalimetalls Barium. Es besitzt die Formel BaCO3 und kommt in der Natur als Mineral Witherit vor.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
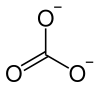 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Bariumcarbonat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | BaCO3 | ||||||||||||||||||
| Kurzbeschreibung |
weißer, geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 197,34 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−1216 kJ·mol−1[4] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Es wird als Bestandteil von Rattengift sowie als Komponente von Zement und Backsteinen verwendet.
Eigenschaften
Das farblose Salz Bariumcarbonat zersetzt sich bei atmosphärischem Druck bei Temperaturen ab 1300 °C zu Bariumoxid und Kohlenstoffdioxid:[2]
Es kristallisiert orthorhombisch, Raumgruppe Pmcn (Raumgruppen-Nr. 62, Stellung 5) mit den Gitterparametern a = 5,313 Å, b = 8,896 Å und c =6,428 Å.[5] Es sind auch Hochtemperaturformen mit den Raumgruppen R3m (Nr. 166) und Fm3m (Nr. 225) bekannt.[6]
Verwendung
Bariumcarbonat wird beispielsweise als Rohstoff für die Herstellung von Wirtschaftsglas und optischem Glas benutzt. Zudem ist es das Endprodukt beim Nachweis von Kohlenstoffdioxid mit Barytwasser. Dieser Nachweis ist nur möglich, weil Bariumcarbonat in Wasser schwer löslich ist. In geringen Mengen wird es in der Fahrzeugindustrie für Speicherkatalysatoren eingesetzt.
Sicherheitshinweise
Bariumcarbonat ist gesundheitsschädlich.[7] Es wirkt reizend auf Schleimhäute, führt zu Funktionsstörungen im zentralen und peripheren Nervensystem, Muskellähmung, gastrointestinalen Beschwerden sowie Herz-Kreislauf- und Lungenfunktionsstörungen.
Weblinks
Einzelnachweise
- Eintrag zu Bariumcarbonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Eintrag zu Bariumcarbonat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.
- Eintrag zu Barium carbonate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- PAETEC Formelsammlung Ausgabe 2003, Seite 116.
- J.P.R. de Villiers: Crystal structures of aragonite, strontianite, and witherite. In: American Mineralogist, 56, 1971, S. 758–766.
- K.O. Strømme: On the Crystal Structures of the High-temperature Forms of Strontium and Barium Carbonate and Structurally Related Compounds. In: Acta Chemica Scandinavica, 29, 1975, S. 105–110, doi:10.3891/acta.chem.scand.29a-0105.
- William Morton: Poisoning by barium carbonate, The Lancet, 1945,2:738–739 (doi:10.1016/S0140-6736(45)91071-3).
