Barbaralon
Barbaralon ist eine chemische Verbindung aus der Gruppe der ungesättigten polycyclischen Ketone, bei dem eine 3,4-Homotropiliden-Einheit mit einer Carbonylgruppe überbrückt ist.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
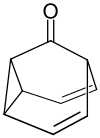 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Barbaralon | ||||||||||||
| Andere Namen |
Tricyclo[3.3.1.02,8]nona-3,6-dien-9-on (IUPAC) | ||||||||||||
| Summenformel | C9H8O | ||||||||||||
| Kurzbeschreibung |
farblose Nadeln[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 132,16 g·mol−1 | ||||||||||||
| Schmelzpunkt |
53,5 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Barbaralon wurde wie der entsprechende Kohlenwasserstoff Barbaralan nach der Chemikerin Barbara M. Ferrier aus der Arbeitsgruppe von William von Eggers Doering benannt.
Darstellung
Die Synthese von Barbaralon wurde 1963 von W. v. E. Doering und Wolfgang Richard Roth publiziert.[3] Cycloheptatrien-7-carbonsäure (1)[4] wird mit Thionylchlorid in das Säurechlorid (2) überführt. Die Umsetzung mit Diazomethan ergibt das α-Diazoketon (3), das in Gegenwart von Kupfer unter Stickstoffabspaltung ein Carben bildet. Dieses reagiert intramolekular unter Bildung eines Cyclopropanrings mit der mittleren Doppelbindung des Cycloheptatrienrings zu Barbaralon (4) und überbrückt somit den Siebenring.[1] Dieser letzte Schritt ähnelt der Wolff-Umlagerung, wobei durch die Anwesenheit der Doppelbindung hier nicht ein Keten, sondern ein Cyclopropanring gebildet wird.
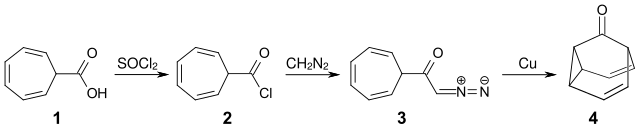
Eigenschaften
Als überbrücktes 3,4-Homotropiliden gehört Barbaralon so wie Barbaralan, Bullvalen oder Semibullvalen zu den Molekülen mit einer „fluktuierenden Struktur“. Aufgrund der degenerierten Cope-Umlagerung stehen zwei strukturidentische Valenzisomere miteinander im schnellen Gleichgewicht:

beim Barbaralon
Da durch die Carbonylgruppe die cisoide Konformation der Homotropilideneinheit fixiert ist, ist die Aktivierungsenergie der Cope-Umlagerung niedriger als beim 3,8-Homotropiliden. Das NMR-Spektrum der Verbindung ist temperaturabhängig. Bei −70 °C zeigt das NMR-Spektrum eine ausgeprägte Feinstruktur für die Signale der fünf unterschiedlichen Wasserstoffatom-Gruppen des Moleküls. Bei 25 °C erhält man die vier Mischsignale der beiden Valenzisomeren.[1]
Barbaralon kann mit einer Wolff-Kishner-Reduktion in den Kohlenwasserstoff Barbaralan überführt werden.[1] Mit deutlich besserer Ausbeute ist Barbaralan zugänglich, indem zunächst mit Lithiumaluminiumhydrid die Carbonylgruppe zum Alkohol (5) reduziert wird, der sich nach Überführung mit Methansulfonylchlorid in die Mesylatverbindung (9) mit Lithiumaluminiumhydrid zu Barbaralan (6) reduzieren lässt.[5]

Einzelnachweise
- W. von E. Doering, B.M. Ferrier, E.T. Fossel, J.H. Hartenstein, M. Jones, G. Klumpp, R.M. Rubin, M. Saunders: A rational synthesis of bullvalene barbaralone and derivatives; bullvalone. In: Tetrahedron. Band 23, Nr. 10, Januar 1967, S. 3943, doi:10.1016/S0040-4020(01)97904-9.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- W. von E. Doering, W. R. Roth: Thermal Rearrangements. In: Angewandte Chemie International Edition. Band 2, Nr. 3, 1963, S. 115–122, doi:10.1002/anie.196301151.
- Externe Identifikatoren von bzw. Datenbank-Links zu Cycloheptatrien-7-carbonsäure: CAS-Nummer: 4440-40-8, PubChem: 13088499, ChemSpider: 10305811, Wikidata: Q82380004.
- Ulrike Weier: Substitutenteneinflüsse auf die Cope-Umlagerung im Barbaralan. Dissertation, Universität Karlsruhe (TH). Karlsruhe 1987.