Augenentwicklung (Wirbeltiere)
Als Augenentwicklung der Wirbeltiere wird die embryonale Bildung (Ontogenese) der Sehorgane bezeichnet. Die Erforschung dieser Prozesse ist Teil der Entwicklungsbiologie. Das Wirbeltierauge zeigt nach Aufbau und Leistungsfähigkeit deutliche Unterschiede zwischen Spezies, während die Phasen seiner Ontogenese grundlegende Gemeinsamkeiten aufweisen. Entwicklungsbiologisch ist das Wirbeltierauge ein Musterbeispiel für ein Organ, das durch eine Verkettung ontogenetischer Auslöseereignisse gebildet wird. Diese sogenannten Induktionen sind dabei so miteinander verknüpft, dass die verschiedenen Komponenten des Auges – wie etwa Linse, Hornhaut und Netzhaut – in einem nach der Reihenfolge der Entwicklungsschritte streng geordneten und wechselseitigen Zusammenhang stehen und so als ein Gesamtsystem auftreten. Evolutionskritiker nahmen lange an, dass diese nur unabhängig voneinander hätten entstehen können und sich folglich ontogenetisch (individuell) auch unabhängig entwickeln würden. Dazu, dass diese Sichtweise heute überholt ist, haben die Erkenntnisse der Entwicklung des Auges beigetragen.
Bei Wirbeltieren oder Schädeltieren werden im Kopfbereich noch vor der Mundbucht die paarigen Fernsinnesorgane der Geruchsempfindung und der Lichtempfindung angelegt. Die Entwicklung der Augen wird im Neuroektoderm initiiert und geht von Furchungen (optische Furchen) beidseits aus, die sich sackförmig ausbuchtend zu einem Paar von Augenbläschen (optische Vesikel) werden. Hierbei handelt es sich um zwei seitliche Ausstülpungen des vorderen Teils des Neuralrohres, die aus dem embryonalen Vorderhirn (Prosencephalon) im Bereich des späteren Zwischenhirns (Diencephalon) hervorgehen. Im weiteren Verlauf kommt es zu einer Reihe von Gewebeinteraktionen, die jederseits zur Bildung der Linse aus dem Oberflächenektoderm führen und zur Einsenkung des Augenbläschens zum Augenbecher. Während das äußere Blatt des Augenbechers zum abschattenden Pigmentepithel wird, entwickelt sich das innere Blatt in komplexen Vorgängen zur Netzhaut mit mehreren Schichten aus licht- bzw. farbsensitiven Fotorezeptorzellen und ihnen zugeordneten Nervenzellen. Die Verbindungen der Nervenzellfortsätze untereinander und die mit anderen Hirnanteilen werden in einem selbstorganisierenden Prozess anhand chemischer Signale geschaffen. Die Ausbildung von Anhangsorganen wie Augenmuskeln, Augenlider und Tränenapparat sind dem nachgeordnete Prozesse, die die Entwicklung des Auges vervollständigen wird. Erst lange nach der Geburt wird diese mit der Koordination der Augenbewegungen, insbesondere bei Lebewesen mit beidäugigem Sehen, sowie der Optimierung der Sehschärfe abgeschlossen.
Die Evolution des Wirbeltierauges
Da die Anatomie des Auges fossil nicht im Detail überliefert ist und zudem der Fossilbericht der frühesten Wirbeltiere und ihrer unmittelbaren Vorfahren faktisch unbekannt ist, basieren die im Folgenden getroffenen Aussagen über die Evolution des Wirbeltierauges auf
- vergleichend-anatomischen Studien des Aufbaus des Auges (auch auf molekularer Ebene) in den einzelnen rezenten Wirbeltiergroßgruppen
- molekulargenetischen Untersuchungen der Verwandtschaftsverhältnisse dieser Wirbeltiergruppen
- dem Einsatz der molekularen Uhr, der es ermöglicht, die Evolutionsschritte einem in der Vergangenheit liegenden Zeitraum zuzuordnen
- vergleichenden Studien zur Embryonalentwicklung in den einzelnen rezenten Wirbeltiergroßgruppen
Die Evolution des Wirbeltierauges lässt sich grob in sechs Phasen gliedern (Abb. 1).[1] Danach hatten in einer ersten Phase bereits vor 600 Millionen Jahren einfache bilaterale Tiere rhabdomerartige (bürstenförmige) und ziliare (mit Wimpern ausgestattete) Fotorezeptoren mit entsprechenden frühen Formen des Sehpigment-Proteins Opsin entwickelt. In diese Sehpigmente sind lichtempfindliche Farbstoffe (Chromophoren) integriert, die entscheidend für die Licht-Wahrnehmung bei Tieren (Phototaxis) sind. Die Rezeptoren können dabei in sogenannten Augenflecken (Ocellen) konzentriert gewesen sein oder aber über den ganzen Körper verteilt.
In einer zweiten Phase zwischen 580 und 550 Millionen Jahren (spätes Proterozoikum) hatten die unmittelbaren Vorfahren der ersten Wirbeltiere fortgeschrittene ziliare Fotorezeptoren mit entsprechendem Opsin-Protein entwickelt. Diese waren den Fotorezeptoren der heute lebenden engsten Verwandten der Wirbeltiere, des Lanzettfischchens (Branchiostoma) und denen der lanzettfischchenähnlichen Larven der Manteltierchen (Tunicata), vermutlich sehr ähnlich.
In Phase drei, vor etwa 550–530 Millionen Jahren (frühes Kambrium), gab es bereits einen Fotorezeptortyp mit Außenmembran und einem für eine abgestufte Signalübertragung an der Synapse geeigneten Ausgang. Das Gewebe des Nervenknotens in der Kopfregion („Gehirn“) bildete beidseitig mit Photorezeptoren bestückte Ausstülpungen (Vesikel, Augenbläschen). Diese Augenbläschen begannen sich nachfolgend wiederum becherförmig einzustülpen, wobei die Innenseite des Bechers die früheste Form der Netzhaut (Retina) darstellt. Mit der Einstülpung des Vesikels ging zudem die Anlagerung einer Frühform des Netzhautpigmentepithels an die „Proto-Netzhaut“ einher. Zudem entstand die Linsenplakode, homolog der gleichnamigen embryonalen Linsenanlage höherer Wirbeltiere. Die Linsenplakode verhinderte aber zunächst nur die Pigmentierung der über dem Augenvesikel liegenden Außenhaut des Kopfes, sodass die Außenhaut an diesen Stellen lichtdurchlässig blieb. Dieses frühe Auge, vor etwa 530 Millionen Jahren, noch ohne die bilderzeugenden Fähigkeiten der Netzhaut, kann mit dem der rezenten Schleimaale (Myxinoidea), den ursprünglichsten rezenten Wirbeltieren, verglichen werden.
Im nächsten, vierten Abschnitt vor etwa 530–500 Millionen Jahren (mittleres Kambrium) evolvierten fünf verschiedene neuartige Fotorezeptorzellen, die Zapfen, jede mit ihrem eigenen ziliaren Opsin, sowie Bipolarzellen und neuartige retinale Ganglienzellen (sogenannte „biplexiforme retinale Ganglionzellen“) als Voraussetzung für die anspruchsvollere Signalweiterleitung zum Sehnerv. Bipolarzellen und Ganglienzellen sind hierbei in einer drei-lagigen Nervenstruktur innerhalb der Netzhaut organisiert. Durch Einstülpung der Linsenplakode in den Augenbecher und anschließende Abschnürung entsteht die Linse. Akkommodation und Iris (und damit die Möglichkeit einer beschränkten Größenveränderung der Pupille) kamen später hinzu, sowie, für die Augenbewegung, extra-okulare Muskeln mit Nervenanbindung. In diesem Zeitraum, vor etwa 500 Millionen Jahren, existierte somit bereits ein Auge, das dem fast aller heutigen Wirbeltiere in Grundzügen vergleichbar war. Es hatte die Bauweise einer einfachen Kamera, konnte daher Bilder sehen und war dem Auge des heutigen Neunauges (Petromyzon) am ähnlichsten.
In Phase fünf, vor 500–430 Millionen Jahren (spätes Kambrium bis spätes Silur) evolvierte Myelin, das für eine schnellere Signalweiterleitung im gesamten Nervensystem sorgt. Dazu kommt ein weiterer neuer Photorezeptor-Typ, die Stäbchen, die Sehen bei schwachem Licht ermöglichen. Mit diesen erschien das für Wirbeltiere charakteristische Sehpigment Rhodopsin. Die Iris wurde hoch kontraktil und konnte die Pupillengröße nunmehr optimal an die Lichtverhältnisse anpassen (Adaptation). An der Innenseite des Augapfels entstanden Muskeln für die Linse, die eine verbesserte Akkommodation ermöglichten. Dieses schon relativ hoch entwickelte Auge kennzeichnete vermutlich die heute ausgestorbenen gepanzerten, kieferlosen Fische („Ostracodermi“) und wahrscheinlich war es auch jenem Auge sehr ähnlich, das bei vielen heutigen Fischen, und damit bei kiefertragenden Wirbeltieren (Gnathostomen), anzutreffen ist.
Im Laufe der sechsten und letzten Phase, die vor etwa 430 Millionen Jahren begann, entstand u. a. auch die Basisversion des Auges der Landwirbeltiere (Tetrapoden). Im Zuge der zahlreichen Anpassungen des fischartigen Wirbeltierorganismus an ein Leben außerhalb des Wassers, die vor ca. 375 Millionen Jahren (spätes Devon) einsetzten, nahm die Linse eine im Querschnitt elliptische Form an. Dies war nötig, da das Licht beim Übergang von Luft in die Hornhaut stärker gebrochen wird, als beim Übergang von Wasser in die Hornhaut. Zum Schutz der Augen vor Austrocknung an der Luft entstand das Augenlid.[1]
Zusammenfassend lässt sich sagen, dass das Wirbeltierauge von den einfachsten, nur hell-dunkel unterscheidenden Vorgängerformen bis zum modernen, zum Sehen hoch aufgelöster, farbiger Bilder befähigten Linsenauge der meisten Gnathostomen einen Evolutionszeitraum von etwa 200 Millionen Jahren benötigte. Alle grundlegenden Merkmale, die auch das Auge des Menschen auszeichnen, könnten nach weiteren 50 Millionen Jahren, am Ende des Devons, bereits vorhanden gewesen sein. Mehr als 200 Millionen Jahre später reduzierten eine Reihe endothermer und damit zur nachtaktiven Lebensweise fähiger Landwirbeltiere (z. B. Eulen oder Katzen) einige dafür unnötige Photorezeptoren wieder und passten ihre Netzhaut noch anderweitig an das Nachtsehen an. Daneben treten auch in anderen Entwicklungslinien der Kiefermäuler Spezialisierungen des Auges mit entsprechender Modifikation des Gnathostomen-Grundtypus auf.
Das Auge als Musterbeispiel vernetzter Auslöseprozesse

Damit die Entwicklung zum Phänotyp in Gang kommt und in der richtigen Reihenfolge abläuft, bedarf es einer ganzen Kaskade von organisierten Gewebeinteraktionen in Form aufeinander folgender und vernetzter Auslöser (Induktionen)[2] (Abb. 2 und 12). Drei spezifische DNA-Abschnitte stehen am Beginn der Kette. Sie enthalten jeweils einen für den gesamten weiteren Entwicklungsverlauf des Auges wichtigen Gentypus, der als Schaltergen, Mastergen, Masterkontrollgen oder Transkriptionsfaktor bezeichnet wird. Hier sind das die Gene Rx1 (retinales Homöobox-Gen), Six3 (lat. sine oculis) und vor allem – gemessen am häufigen Vorkommen in der Fachliteratur – das von Gehring 1995 entdeckte Gen Pax6 (engl. paired box 6 gene).[3]

Im Weiteren wird die Induktion der Linsenplakode (Linseninduktion) und damit die Entstehung der Linse durch zwei hauptsächliche Faktoren getrieben, erstens das Vorhandensein der Expression von Pax6 in der Epidermis des Kopfs und zweitens das Vorhandensein des spezifischen Ektoderm-Gewebes. Die mit Pax6 und anderen Genen verbundenen Schritte der frühen Entwicklung des Linsenauges sind evolutionsgeschichtlich tief verankert und artenübergreifend vielfach übereinstimmend. Pax6 selbst ist bei Maus und Mensch vollkommen identisch. Die genannten Gene Pax6, Rx1 und Six3 sind ein notwendiger und hinreichender Regelkreis für die Augeninduktion beim Wirbeltier. Durch Verwendung von Pax6 der Maus konnten zunächst bei der Taufliege in einem Experiment auf die Beine verlagerte (ektopische) Augen induziert werden.[4] Dieses spektakuläre Experiment, mit dem die Funktion des zu Pax6 homologen Gens eyeless der Fliege vollständig erfüllt wurde, bewies die hohe Konservierung von Pax6. Gleiches gelang später zumindest ansatzweise beim Wirbeltier,[5] unter anderem beim Hühnchen (1995)[6] oder mittels Sox3 beim Krallenfrosch (Xenopus laevis) (2000).[7] In diesen Versuchen kam es zur Herausbildung ektopischer Linsen oder Plakoden. Dass die Versuche nicht zu so vollständigen Ergebnissen geführt haben wie bei der Fruchtfliege, lässt auf die höhere Komplexität der Wirbeltiere schließen. In jedem Fall unterbleibt die Augenentwicklung beim Wirbeltier gänzlich, wenn Pax6 unterdrückt wird (Abb. 3).
Die genannten drei Masterkontrollgene bilden ein stabilisierendes Netzwerk aus, durch das neue Induktionen angestoßen[8] und hunderte weiterer Gene aktiviert werden. Beim Auge der Taufliege sind es 2000 Gene. Allein etwa die Pigmentierung der Iris, also die Augenfarbe, erfordert mindestens 16 verschiedene Gene.[9] Weitere Induktionen schließen sich im folgenden Verlauf der Augenentwicklung an. Sie leiten jeweils umfangreiche Entwicklungsschritte unter Einbeziehung vieler nachgeschalteter Gene ein, etwa die Entstehung der Linse und der Hornhaut (Abb. 2).
Die Rolle des Gens Pax6
Die nach seiner Entdeckung eingeräumte extreme Sonderstellung von Pax6 als das Masterkontrollgen für die Augenentwicklung kann nach 20 Jahren neu beurteilt werden. Für die Besonderheit von Pax6 als Mastergen spricht erstens, dass es einerseits früh, nämlich bereits in Augenstammzellen, andererseits in vielen Geweben während der gesamten Augenentwicklung exprimiert wird, und zwar bei der Fruchtfliege, bei Mensch und Tintenfisch. Bei diesen Arten aus verschiedenen Tierstämmen wird die Augenentwicklung als unabhängig angenommen. Pax6 kann daher seit einem gemeinsamen Vorgänger als konserviert gelten. Zweitens führt die Reduzierung seiner Expression zu einer verminderten Augengröße bei Drosophila, Maus und Mensch. Drittens kann Pax6-Fehlexpression in bestimmten Geweben, z. B. im Drosophilaflügel oder -bein ektopische Augen hervorrufen.
Gegen eine herausragende oder gar alleinige Mastergenstellung von Pax6 in der Augenentwicklung sprechen die folgenden Fakten: Erstens führt die Eliminierung von Pax6 bzw. die des homologen Gens Eyeless bei Drosophila, das ebenfalls zur Pax6-Familie zählt und bei der Fliege vergleichbare Funktion hat, nicht allein zum Verlust des Auges, sondern auch von weiteren Gehirnteilen, im Extremfall bei Drosophila zum totalen Kopfverlust.[10] Zweitens nehmen weitere Gene neben Pax6 Schlüsselstellungen bei der frühen Augenentwicklung ein, so etwa neben den genannten Rx1 und Sine oculis (Six)[11] auch Eyes absent (Eya)[12] oder Dachshund (Dach).[13] Diese Gene können ebenfalls ektopische Augen induzieren. Ihr Funktionsverlust führt ebenfalls zum Verlust des Auges. Sie zeigen somit ähnliche Masterkontrollgen-Eigenschaften wie Pax6.
Zusammenfassend werden somit aus gegenwärtiger Sicht weniger die bekannten stammesübergreifenden Charakteristika von Pax6 in Frage gestellt. Sie werden jedoch im Vergleich zu den Fähigkeiten anderer Mastergene heute relativiert. Es muss daher nach dem gegenwärtigen Stand der Wissenschaft von der evolutionären Konservierung des Regulationsnetzwerks einer ganzen Gruppe von Genen gesprochen werden.[3]
Phasen der Augenentwicklung
Frühe Entwicklungseinleitung eines Augenfeldes
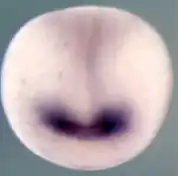
Das Linsenauge des Wirbeltiers kann als ein aus dem Gehirn auswachsendes Sinnesorgan gesehen werden. Bereits am Ende der Gastrulation werden die ersten Weichen für die Entwicklung des Auges gestellt. Das ist noch in einer frühen Phase der Embryonalentwicklung der Fall, wenn die Bildung der drei Keimblätter Entoderm, Mesoderm und Ektoderm (Innenschicht, Mittelschicht, Außenschicht) zum Abschluss kommt. Beim Auge wie bei den anderen Sinnesorganen ist das Ektoderm das wesentliche Keimblatt, aus dem sich die Strukturen entwickeln. Beim Menschen geschehen diese ersten Schritte ab dem 17. Tag der Schwangerschaft.
Die Entwicklung der schuhsohlenförmigen Neuralplatte auf der Gastrula (Abb. 4, hellgraue Fläche), aus der zuerst das Neuralrohr (Abb. 4, senkrechter Mittelstreifen) und daraus später das Gehirn und Rückenmark entstehen, wird durch das darunter liegende Mesoderm ausgelöst (induziert), und es kommt zur Ausbildung zunächst eines uniformen Augenfelds auf dieser Patte (Abb. 4, violett). Die genannten Schaltergene Rx1, Six3 und Pax6 sind wesentlich für die initiierenden Schritte. Während der Bildung des Neuralrohrs teilt sich das Augenfeld in zwei äußere Augendomänen, gesteuert durch das Gen Sonic hedgehog (Shh), das in einer Mittellinie zwischen diesen beiden Domänen aktiviert wird und Pax6 unterdrückt. Sonic hedgehog liefert damit die Erklärung dafür, dass das Wirbeltier zwei Augen hat. Bleibt seine Exprimierung an dieser entscheidenden Stelle aus, entwickelt sich Zyklopie.[14] Eine ausbleibende Aktivierung (Expression) der genannten Schaltergene führt zum Verlust der Augenbildung.[8]
Augenvesikel und Linsenplakode
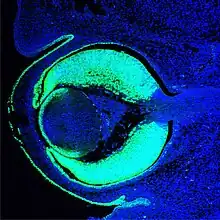
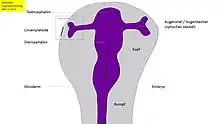


In der Folge kommt es beim Menschen etwa zum Beginn des 2. Schwangerschaftsmonats an den Augenfeldern zu einer beidseitigen Ausstülpung des vorderen Neuralrohres und zu ihrem Auswachsen als optische Augenbläschen aus dem Zwischenhirn (Abb. 6),[8] Augenstiel genannt. Demnach erreichen die hierüber eingehende Erregung zunächst das Zwischenhirn, die Verarbeitung erfolgt im Großhirn.
Das Ausstülpen der Augenbläschen beruht auf individueller Zellmigration. Wie zuerst beim Fisch entdeckt, gibt das Protein Rx3 den Augenvorläuferzellen molekulare Wegweiser mit. Sie vermitteln diesen Zellen die Information, wie sie sich aus der Mitte des Gehirns in Richtung Augenfeld bewegen können, wo es zu größeren Ansammlungen dieser Zellen kommt.[15][16] Das auswachsende optische Vesikel interagiert mit der äußeren Schicht und löst als neuen wichtigen Induktionsschritt dort die Bildung der Linsenplakode aus, eine Verdickung dieses Ektoderms und Einbuchtung der Augengrube (Abb. 5 und 6). Ohne das Vesikel entstünde (mit Ausnahme von Amphibien) keine Verdickung und keine Linse. Durch verschiedene mesodermale Signalgebungen und Signale des optischen Vesikels wird das Oberflächenektoderm immer stärker auf die prospektive Linsenbildung vorbereitet. Das Gewebe wird zunächst für die Linsenbildung als kompetent bezeichnet und wird in weiteren Schritten linsenspezifisch.[17] Das Gewebe kann nach dem Kontakt mit dem Vesikel und dessen Signalen nur noch Linse werden. Nur die Oberhaut des Kopfes (Epidermis) ist somit in der Lage, auf Signale des optischen Vesikels zu reagieren. In empirischen Versuchen konnte gezeigt werden, dass ein Vesikel, das man in eine andere Region als dem Kopfektoderm einpflanzt und dort auswachsen lässt, zu keiner Linsenbildung führt. Aber auch verpflanztes Oberflächenektoderm des Kopfs führt zu keiner Linse, wenn dort der Kontakt zum optischen Vesikel fehlt.
Die Verdickung des Ektoderms führt zur Umformung des Vesikels zu einem Becher, dem Augenbecher (Abb. 7). Dieser sorgt durch entsprechende Induktionssignale dafür, dass die zunächst noch nicht transparente Linse entsteht.[2] Nach deren anfänglicher Formation schließt sich das Oberflächen-Ektoderm wieder über dem Vesikel. Das Linsenbläschen löst sich vom Ektoderm ab und sinkt in die Tiefe (Abb. 8).
Linse und Hornhaut
Die frühe Linse, das aus der Linsenplakode hervorgehende Linsenbläschen, ist zunächst ein hohler Ball aus umliegenden Zellen (Abb. 9.1). Jede dieser Zellen enthält einen Zellkern mit Chromosomen und DNA. Die anteriore Seite ist zur Außenseite, die posteriore zur Innenseite des Auges gerichtet (Abb. 9.2). Die Zellen sind von einer Kapsel mit proteinhaltigem Material umgeben (nur in Abb. 9.1 u. 9.6 gezeigt). In einem ersten Schritt verlängern sich ab der fünften Woche beim Menschen die posterioren Zellen in den Hohlraum hinein (Abb. 9.2, blaugrau). Sie formen primäre Linsenfasern, den späteren Linsenkern. Das Anschichten um den zentralen Kern geschieht immer vom Linsenäquator aus (Abb. 9.4).[18] Bei der Verlängerung bilden diese Fasern mehrere Proteine, die Kristalline. Diese füllen den Hohlraum der Linse aus und bilden später mit 3 Typen und 90 % Anteil aller Proteine der Linse deren Hauptkomponenten.[19] Zunächst bilden sie die Linsenfasern. In der Folge bauen die Linsenfaserzellen ihren Zellkern sowie andere Organellen, darunter auch die die Energiezentren (Mitochondrien) ab (Abb. 9.3, blau). Dadurch wird der Zellstoffwechsel drastisch reduziert, die Lichtstreuung minimiert. Dieser Vorgang führt nicht, wie sonst üblich, zu programmiertem Zelltod (Apoptose). Auf Grund dieser Vorgänge können und müssen sich die Linsenzellen bis zum Tod nicht mehr erneuern.
Die anterioren Zellen bleiben als eine einlagige Zellenschicht an der äußeren Oberfläche der Linse bestehen (Linsenepithel), auch bei der fertig entwickelten Linse. Sie teilen sich ständig weiter, wobei am oberen und unteren Ende beim Menschen ab der siebten Woche sekundäre Linsenfasern entstehen (Abb. 9.3, rot). Diese Linsenfasern werden sehr lang und überlagern die Linse in konzentrischen Ringen zwiebelschalenartig in vielen Lagen.[20] Dazu wachsen stets neue sekundäre Linsenfasern aus den genannten Positionen oben und unten um die Linse herum (Abb. 9.4), verdrängen die zuvor gebildeten sekundären Linsenfasern nach innen ab, während immer neue sekundäre Linsenfasern generiert werden (Abb. 9.4, braun), die gleichermaßen um die Linse herum wachsen. Fortlaufend bildet die anteriore Außenschicht durch Zellteilung Nachschubmaterial für diesen Prozess. Durch die fortlaufende Bildung neuer Ringe kann die Linse wachsen (Abb. 9.6).[21] Während der gesamten Zeit der vorgeburtlichen Linsenentwicklung ist über diese posterior und seitlich ein vaskuläres, blutgefäßhaltiges Netz ausgebreitet, die Tunica vasculosa lentis, die erst kurz nach der Geburt verschwindet.
Die Bildung neuer sekundärer Linsenfasern hält im Verlauf des gesamten Lebens des Organismus an. Dabei vergrößert sich die Linse nicht mehr wesentlich, nimmt aber an Dichte zu. Die entwickelte Linse enthält einen Nukleus aus frühen Zellen (Abb. 9.6, hellblau). Mit zunehmendem Alter nimmt die Elastizität der Linse ab, dabei verliert sie mehr und mehr die Fähigkeit zur Akkommodation. Die fertige Linse besteht als einziges organisches Gewebe aus völlig transparenten, lebenden Zellen.

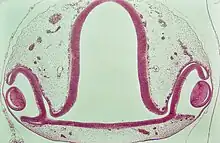
Die Linse kann bei einem Salamander regeneriert werden. Das geschieht durch Transdifferenzierung, eine schrittweise Rückentwicklung von Zellen am mesodermalen Irisrand in einen früheren Zustand (Wolffsche Linsenregeneration). Die Linse ist dabei bis zu 18 mal regenerierbar.[22] Auch bestimmte Gewebe der Iris und der neuralen Retina sind bei Salamandern regenerierbar.[23]
Als nächster Prozess nach der Linseninduktion erfolgt nochmals eine Induktion, diesmal der Linse mit dem Oberflächenektoderm. Sie führt dort zu einer neuen Verdickung, der Hornhaut (Abb. 5 u. 8).[2] Im Gegensatz zu den Zellen der Linse haben Hornhautzellen eine extrem kurze Lebensdauer und erneuern sich auch nachgeburtlich wöchentlich. Die Hornhaut ist stark mit Nerven durchdrungen. Der vordere Becherrand wird zur Pupille. Die Hornhaut (Cornea) entsteht durch eine Transformation des Oberflächenektoderms in anteriores Epithelium. Die Aderhaut (Chorioidea), Lederhaut (Sclera) entsteht aus dem mesodermalen Mesenchym des Kopfbereichs. Mit der Ausbildung der Lederhaut kann die Entstehung von Blutgefäßen einsetzen, die die Netzhaut durchziehen.
Netzhaut

Bevor es zur Differenzierung der Netzhaut kommt, besteht das Gewebe aus einem Feld undifferenzierter Retina-Vorläuferzellen. Vergleichbar zu den vorangegangenen Phasen der Vesikel- oder Linseninduktion müssen geordnete Schritte der Zelldifferenzierung etabliert werden. Alle diese Retina-Vorläuferzellen exprimieren zu diesem Zweck eine gemeinsame Suite von Transkriptionsfaktoren, das sind Gene, die wieder andere Gene exprimieren. Dies sind Pax6, Six3, Six6, Lbx2, Hes1. Die Zellen sind in diesem Stadium noch multipotente Stammzellen, das heißt, sie können sich noch zu unterschiedlichen Zielzellen differenzieren. Aus diesen werden neben den teilweise lichtleitenden Müllerzellen später vor allem die Fotorezeptorzellen sowie verschiedene Typen von Nervenzellen, die sie als Horizontalzellen untereinander verschalten oder nachgeschaltet den Signalfluss formieren, wie Bipolarzellen, und modulieren, wie Amakrinzellen, bevor er die Ganglienzellen der Retina erreicht, deren Fortsätze dann Signale aus dem Auge an andere Hirnbereiche weiterleiten können.[24] Die Mechanismen, die hier eine akkurate Zelldifferenzierung zur Entwicklung der Netzhaut gewährleisten, sind Genaktivitäten sowohl aus dem optischen Vesikel (intrinsisch) als auch aus mesenchymen Regionen außerhalb des Auges (extrinsisch). Hierbei spielen Fibroblasten-Wachstumsfaktoren (FGF) eine wichtige Rolle.[25] Eine sich selbst verstärkende Sonic hedgehog-Expressionswelle, die durch die Ganglienzellschicht „schwappt“, veranlasst als erste die Ganglienzellen zu differenzieren.[26] Eine weitere Shh-Welle, die quer durch die innere Schicht exprimiert wird, gibt den Startschuss zur Differenzierung weiterer neuronaler Zellen der Netzhaut. Beide Entdeckungen wurden beim Zebrafisch gemacht.[27]
Die Wand des Augenbechers besteht jetzt aus einem äußeren und einem inneren Blatt, in dem sich später weitere Netzhautschichten ausbilden (Abb. 7 einfach, Abb. 10 innere Schicht detaillierter). Das dünne, nach außen weisende Blatt (Abb. 8) formt das retinale Pigmentepithel, das abdunkelt, Licht absorbiert und der Regeneration der Sinneszellen dient. Der Aufbau des dickeren Innenblattes wird im Folgenden näher beschrieben. Diese neuronale Retinaschicht besteht aus Nervenzellen und wird in weitere innere und äußere Unterschichten unterteilt (Abb. 10). Im Laufe der Entwicklung bildet sich in der neuronalen Schicht eine weitere mittlere Unterschicht mit den bipolaren Zellen der Retina. Ihre Aufgabe ist es, die Informationen der lichtempfindlichen Fotorezeptoren (Stäbchen und Zapfen) zu sammeln, zu gewichten und an die Ganglienzellen der Netzhaut nach innen (Abb. 10 links) weiterzuleiten. Zusammengefasst entwickeln sich also in der Netzhaut des Auges ähnlich wie bei anderen Sinnesorganen, etwa dem Ohr, im Wesentlichen drei, hier übereinander liegende Zellschichten: Rezeptorzellen, bipolare Zellen und Ganglienzellen, deren Neuriten zu Regionen des Gehirns projizieren. Diese Anordnung gilt gleichermaßen für den Menschen wie für andere Wirbeltiere.
Die Ausbildung von Zapfen und Stäbchen erfolgt auf der äußeren Seite der inneren Schicht (Abb. 10 rechts, Zellkerne der Fotorezeptoren vor weißer Hintergrundschicht, lichtsensitive, langgezogene Fortsätze vor brauner Hintergrundschicht). Die drei verschiedenen Zapfentypen beim Menschen dienen der Unterscheidung von Farbtönungen des Lichts. Die Stäbchen vermitteln die Intensität allein als Helligkeit. Da beim Menschen nur ein Typ von Stäbchen vorhanden ist, kann bei ihm in der Dämmerung kein Farbeindruck entstehen. Nachtaktive Wirbeltiere haben mehr Stäbchentypen entwickelt.
Der Großteil der komplexen Retinaentwicklung verläuft beim Menschen in einer koordinierten Zellwachstumswelle ab der Mitte des 3. Monats bis in den 4. Monat. Dann ist der Sehnerv für eine adäquate Signalweiterleitung vollständig myelinisiert. Der gelbe Fleck (Macula lutea) mit der größten Dichte an speziellen Zellen (Zapfen) beginnt sich erst nach 8 Monaten auszubilden.[28] Er wächst bis über die Geburt hinaus weiter. Nach fünf Monaten etwa ist die Nervenverbindung des Auges mit dem Gehirn abgeschlossen. Der Embryo zeigt bereits im 7. Monat der Schwangerschaft bestimmte Formen von Augenbewegungen, das sogenannte Rapid Eye Movement (REM), das die Synchronisation der Netzhaut mit dem visuellen Cortex im Gehirn unterstützt[29] und auch nach der Geburt in bestimmten Schlafphasen auftritt, deren Bedeutung noch erforscht wird (siehe REM-Schlaf).
Lichtabgewandte (inverse) Lage der Fotorezeptoren
Das Wirbeltierauge wird als Teil des Gehirns angesehen, da seine erste Anlage aus diesem hervorgeht. Dies ist zum Beispiel beim Oktopus, der nicht zu den Wirbeltieren, sondern zu den Kopffüßern zählt, nicht der Fall, bei dem das Auge durch Einstülpung der äußeren Oberfläche entsteht. Der Entwicklungsvorgang beim Wirbeltier mit einer invertierten Retina hat mehrere Konsequenzen: Erstens generiert der inwendig gebündelte, zum Gehirn führende Sehnerv einen blinden Fleck, da sich an der Stelle, wo er aus dem Auge austritt, keine lichtempfindlichen Sinneszellen befinden. Zweitens liegen die Nervenfasern, Nervenzellen und Blutgefäße auf der zum Licht hin gerichteten Innenseite, sodass das Licht diese durchqueren muss, bevor es die Fotorezeptoren erreicht. Drittens sind die langen Fotorezeptorfortsätze der Zapfen und Stäbchen nach außen zum Pigmentepithel hin gerichtet – also vom Licht weg.[30][31] Das Licht muss demnach also sowohl die aufliegenden Schichten durchqueren als auch ungestreut die Fotorezeptoren selbst, bevor es auf deren lichtsensitive Außensegmente trifft (Abb. 10). Beim Oktopus gestaltet sich der Weg einfacher; bei ihm trifft das Licht unmittelbar auf die Rezeptoren.
Bei sonst gleichen und gleich gut ausgebildeten Komponenten des Auges deutet die invertierte Retinastruktur des Wirbeltiers auf eine „suboptimale“ evolutionäre Lösung hin. Der Octopus könnte bei wenig Licht möglicherweise besser sehen, da hier den eintreffenden Lichtsignalen weniger Hindernisse im Wege stehen. Evolutionäre Lösungen müssen jedoch gemäß der Evolutionstheorie nicht perfekt sein, sie müssen nur so gut sein, dass die Art ausreichend gut an ihre jeweiligen Umgebungsbedingungen angepasst ist, um überleben zu können.[32] Das invertierte Linsenauge ist bei den Nachtvögeln durch eine Verbesserung der Netzhauteigenschaften an das Sehen im Dunkeln adaptiert.
Die strukturellen Unterschiede bei Wirbeltier und Octopus deuten zumindest beim Konstruktionselement der Netzhaut auf eine voneinander unabhängige, konvergente Entstehungsgeschichte dieser Augentypen hin. Auf der anderen Seite liegen mit den Schaltergenen übereinstimmende, zumindest aber ähnliche und damit homologe genetische Grundlagen vor. Die Entwicklungsgenetik des Auges gibt mit dem gleichzeitigen Bezug auf Konvergenz und Homologie somit mehrdeutige Hinweise auf seine Evolutionsgeschichte. Mit anderen Worten: Fotorezeptoren oder das Auge initiierende Gennetzwerke können einmal oder mehrfach entstanden sein, bestimmte Konstruktionselemente des Auges, wie etwa Linse oder mehrschichtige Netzhaut, sind in jedem Fall mehrfach unabhängig entstanden.
Sehbahn und ihre Bestandteile

Neben den Stäbchen und Zapfen als Fotorezeptoren des Auges bildet die Netzhaut auch einige Millionen Nervenzellen für eine erste Informationsverarbeitung. Damit das Auge als Sinnesorgan funktionieren kann, müssen die eingehenden Lichtinformationen an das Gehirn als „Auswertestationen höherer Ordnung“[2] weitergeleitet werden. Zunächst bilden sich Ganglienzellen auf der inneren Retinaschicht (Abb. 11, links). Diese Zellen bilden Nervenfasern (Axone) aus, die die Netzhautschicht durchdringen und in der Folge bestimmte Zielgebiete im Gehirn suchen und finden müssen. Die Steuerung dieser topografischen Zielerreichung ist ein selbstorganisierender Vorgang (Axon guidance). Komplizierte chemische Prozesse sind dafür verantwortlich: Moleküle in der Netzhaut und im Mittelhirn (Tectum) bilden gestufte chemische Gradienten aus. Deren durch Diffusion entstehende Konzentrationsgefälle helfen, die Wachstumsrichtung der Axone zu lenken.[33] Die Axone werden am blinden Fleck gebündelt und bei Säugetieren von dort als dem zentralen Nervenstrang, dem Sehnerv (Nervus opticus), über die Sehbahn mit verschiedenen neuronalen Strukturen an das Sehzentrum (visueller Cortex) weitergeführt (Abb. 11). Sie erreichen nach einer Zwischenstation zuerst das primäre Sehzentrum für eine Vorverarbeitung und danach das sekundäre Sehzentrum. Auf diesem Weg kommt es zu einer partiellen Sehnervenkreuzung (Chiasma opticum). Die Sehnervenzellen des linken Auges erreichen das primäre Sehzentrum sowohl der linken als auch der rechten Gehirnhälfte. Entsprechendes gilt für die Nervenzellen des rechten Auges. Im Empfangsbereich des Gehirns müssen die bereits in mehreren Einzelsträngen ankommenden Nervenzellen weiter aufgefächert werden, damit eine präzise Verarbeitung möglich wird. Je nach Ursprungsort münden die Axone in verschiedenen, eng umschriebenen Arealen. Der Prozess wird retino-tectale Projektion genannt. Er wird maßgeblich gesteuert durch Ephrine (Gradienten) und Ephrinrezeptoren.[33][34] Einer Landkarte auf der Netzhaut entspricht dabei eine Kopie dieser Landkarte im Gehirn. Bei Nichtsäugern (Fische, Amphibien, Reptilien und Vögel) bildet sich eine vollständige Kreuzung der Nervenbahnen aus. Dabei werden alle Axone einer Augenseite auf die jeweils gegenüberliegende Gehirnseite geführt.[2] Der Effekt der Sehnervenkreuzung kann beim Krallenfrosch Xenopus laevis experimentell gezeigt werden, indem ein Augenbecher entfernt und umgekehrt reimplantiert wird. Es erfolgt eine ungekreuzte Zuordnung der Netzhautregionen im Mittelhirn.[35] Das Tier bewegt bei der Nahrungssuche seine Zunge an falsche Stellen und lernt erst mit der Zeit eine korrekte Orientierung.
Äußere Augenmuskeln

Beim Wirbeltier werden in Abhängigkeit von ihrer Funktion und Lage die inneren von den äußeren Augenmuskeln unterschieden. Die äußeren, für die Augenbewegungen zuständigen Augenmuskeln entstehen zusammen mit der Tenonschen Kapsel (Teil des Bandapparates) und dem Fettgewebe der Augenhöhle (Orbita). Sie sind gemeinsame Abkömmlinge des embryonalen Bindegewebes (Mesenchym), das die Augenvesikel umgibt, und werden aus sogenannten Somitomeren gebildet, bestimmten Mesodermsegmenten des Rumpfbereichs beim Embryo, die beidseitig auswachsen (Abb. 12). Die später durch den Nervus oculomotorius versorgten Augenmuskeln (oberer gerader Muskel, unterer gerader Muskel, innerer, nasal gelegener, gerader Muskel und unterer, schräger Muskel) stammen dabei gemeinsam mit dem Lidheber aus den vordersten beiden Somitomeren 1 und 2, der obere schräge Muskel aus dem dritten und der seitliche gerade Muskel, sowie der beim Menschen nicht mehr vorhandene Zurückzieher des Auges, aus dem fünften Somitomer.[36][37][38] Die Muskelzellen aus den Myotomen der Somiten migrieren hierbei in ihre Zielgebiete in den Augen, wo anschließend die Muskelstrukturen gebildet werden.
Die weitere Entwicklung wird von drei Wachstumszentren gesteuert, denen jeweils ein Nerv zugeordnet ist. Daraus entsteht die spätere motorische Nervenversorgung (Innervation) der Augenmuskeln durch die drei Hirnnerven Nervus oculomotorius (III), Nervus trochlearis (IV) und Nervus abducens (VI). Die Entwicklung der äußeren Augenmuskeln ist abhängig von einer normalen Entwicklung der Augenhöhle, während die Ausbildung des Bandapparates davon unabhängig ist.[39] Die Augenmuskulatur entwickelt sich beim Menschen spät, erst im fünften Monat. Eine vollständige Koordination aller Formen von Augenbewegungen erfolgt erst nach der Geburt im Säuglingsalter und findet in der Regel zwischen dem 2. und 4. Lebensmonat statt.[40]
Augenlider
In der 7. Woche entstehen die Augenlider in Form von zwei Hautfalten, die von oben und unten über das Auge wachsen und wegen der Verklebung ihrer Epithelränder zwischen der 10. Woche und dem 7. Monat verschlossen sind. An ihrem Rand entstehen die Wimpern, und es kommt durch Einsprossungen von Epithelsträngen in das Mesenchym zur Ausbildung der Meibom- und Moll-Drüsen. In dieser Phase entsteht zudem die als „drittes Augenlid“ bezeichnete Nickhaut im nasalen Lidwinkel. Gleichzeitig bildet sich aus dem Kopfmesenchym die Bindehaut.[41][42]
Tränenapparat
In der 9. Schwangerschaftswoche zieht eine Reihe von Epithelsprossen aus dem seitlichen Bindehautsack in das darunter liegende Mesenchym, aus denen die Anlage der Tränendrüsen gebildet werden. Sie werden durch die Sehne des Musculus levator palpebrae superioris in zwei unterschiedlich große Anlagen geteilt. Aus der sogenannten Tränen-Nasen-Rinne, die sich etwa in der 7. Schwangerschaftswoche am äußeren Nasenwall bildet, entstehen die ableitenden Tränenwege. Deren Aushöhlung beginnt zwar bereits im 3. Schwangerschaftsmonat, jedoch öffnen sich ihre Ausflussstellen erst im 7. Monat der Schwangerschaft.[41]
Pupille und innere Augenmuskeln

Etwa in der 8. Schwangerschaftswoche bildet sich beim Menschen durch die Abrundung der Augenbecheröffnung die Pupille, die unter anderem als Lochblende dynamisch auf Lichteinfall reagiert. Zwischen dem Augenbecher und dem Oberflächenepithel entstehen die inneren Augenmuskeln, Musculus sphincter pupillae und Musculus dilatator pupillae. Ihre Zellen entstammen den ektodermalen Epithelzellen des Augenbechers.[42] Der Ziliarmuskel, der das Auge fortlaufend auf die unterschiedlichen Objektentfernungen einstellt, entsteht aus dem Mesoderm innerhalb der Aderhaut und wird als ein Derivat der Neuralleiste betrachtet.[43]
Im Endstadium der Schwangerschaft kommt es beim Embryo zu Pupillenreaktionen, die entgegen früherer Anschauung bereits in der Gebärmutter möglich und notwendig sind. Eine Pupillenerweiterung durch den hierfür zuständigen Musculus dilatator pupillae, der über das Sympathische Nervensystem, einen Teil des vegetativen Nervensystems, gesteuert wird, kann insofern auch Ausdruck emotionaler Erregung sein. Die Lichtreaktion kontrolliert die Anzahl der Neuronen in der Netzhaut. Gleichzeitig reguliert sie die Entwicklung von Blutgefäßen in den Augen. Die Photonen im Mutterleib aktivieren im Mäuse-Embryo ein Protein Melanopsin, das die normale Entwicklung von Gefäßen und Neuronen in Gang setzt.[44]
Weitere Entwicklung nach der Geburt
Die Entwicklung des Auges ist bei der Geburt noch nicht abgeschlossen. Es hat seine volle Größe erst zu Beginn der Pubertät erreicht und erfährt im ersten Jahr noch eine Reihe von Veränderungen (Abb. 13). So vergrößert sich das Gesichtsfeld; die Linse, die Macula und die Pigmentierung der Iris erfahren strukturelle Verbesserungen. Eine vollständige Koordination aller Formen von Augenbewegungen und somit die Ausbildung von beidäugigem Sehen dauert bis einige Monate nach der Geburt. Viele Zellen des Corpus geniculatum laterale, eines Teils der Sehbahn, können noch nicht auf die von den Ganglienzellen der Netzhaut eingehenden Lichtreize reagieren. Die Sehschärfe (Visus) ist bei der Geburt auch auf Grund einer noch instabilen zentralen Fixation noch nicht vollständig ausgebildet. Tatsächlich entwickelt sich der Visus bis etwa zum 10. Lebensjahr.[45][46]
Pathologie
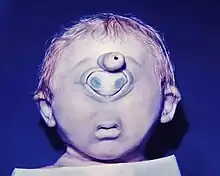
Die wohl spektakulärste Fehlbildung ist das schon erwähnte Zyklopenauge, die Zyklopie. Durch Unterbleiben des Auseinanderweichens der beiden Augenanlagen bildet sich ein Konglomerat von Augenteilen in der Mitte der oberen Gesichtshälfte (Abb.). Wegen der damit verbundenen Gehirnmissbildung sind die Feten nicht überlebensfähig. Unvollständiger Verschluss des embryonalen Augenbechers führt zu Spaltbildungen unterschiedlichen Ausmaßes, den Iris-, Aderhaut- und Netzhaut-Kolobomen. Viruserkrankungen der Mutter im ersten Drittel der Schwangerschaft, aber auch die Einnahme mancher Medikamente, können zu Entwicklungsstörungen führen. Bekannt ist die Linsentrübung neben anderen Schäden durch Rötelninfektion in der 4. bis 8. Schwangerschaftswoche, also in der Phase der Linsenentwicklung. Nicht selten sind beim Menschen persistierende Reste der Pupillarmembran als in der Regel harmlose Hemmungsmissbildung. Nur vereinzelt sind Blutungen daraus beobachtet worden. Sie sind auch bei Wirbeltieren (Ratten, Kaninchen) beschrieben.[47]
Besonderheiten bei ausgewählten Wirbeltieren

Wirbeltieraugen müssen spezifischen Anforderungen genügen, etwa für die Wahrnehmung bei Dunkelheit (Katzen, Nachtvögel) oder ein scharfes Sehen in großer Entfernung (Greifvögel). Insbesondere Katzen, aber auch Hunde, Pferde und Rinder haben beispielsweise als Restlichtverstärker für eine erhöhte Nachtsichtfähigkeit eine retroreflektierende Schicht hinter oder inmitten der Netzhaut entwickelt, das Tapetum lucidum (Spiegelauge) (Abb. 14).[48] Bei Greifvögeln treten andere Entwicklungsunterschiede hervor. Ihre Augen sind verhältnismäßig groß, was einen hohen Lichteinfall und damit ein großes Abbild des Sehobjekts auf der Retina und im Gehirn ermöglicht. Die großflächigere Aufteilung des fixierten Objekts auf eine höhere Anzahl von Netzhautzellen führt zu einem detailreicheren Bild.
Die Augen der Greifvögel werden auf der Kopfvorderseite, also frontal ausgebildet, was die gleichzeitige Wahrnehmung eines Objekts mit beiden Augen ermöglicht. Gestattet diese Anordnung binokulares Einfachsehen, ist dies, wie beim Menschen, die Voraussetzung für räumliches Sehen.
Für optimiertes Scharfsehen entwickeln Greifvögel eine hochspezialisierte, neuromuskuläre Akkommodation. Hierbei passen feine Ziliarmuskeln die Wölbung der Linse an wechselnde Objektentfernungen an. Im Weiteren entwickeln Greifvögel neben der Fovea centralis eine zweite, seitliche Sehgrube in der Retina.[49] Hier liegt, wie in der zentralen Sehgrube, eine Verdichtung von Zapfen vor. Schließlich verfügen alle Vögel über einen kammartigen Augenfächer innerhalb des Glaskörpers, den Pecten oculi.[50] Diese mit engen Kapillaren durchzogene Struktur sorgt für eine verstärkte Durchblutung und Nährstoffversorgung der Netzhaut.

Der Mensch sieht in unterschiedlichen Entfernungen scharf, indem er den Krümmungsradius der Linse ändert und auf diese Weise den Brennpunkt verschiebt. Denselben Effekt erzielen Schlangen und Fische, indem sie den Abstand von der Linse zur Netzhaut verändern. Durch einen speziellen Muskel können Fische die Linse aus dem Ruhezustand in Richtung zur Netzhaut ziehen, Schlangen nach vorne. Schlangen besitzen kein Augenlid. Vielmehr ist die Augenoberfläche von einer transparenten Schuppe überzogen. Unterschiede herrschen ferner bei der Farbwahrnehmung. Während der Mensch drei Zapfentypen ausbildet (trichromatisches Sehen), entwickeln die meisten Säugetiere nur zwei Rezeptortypen (dichromatisches Sehen), Reptilien und die aus ihnen hervorgegangenen Vögel dagegen vier (tetrachromatisches Sehen),[51] Tauben sogar fünf. Vögel können im Gegensatz zum Menschen UV-Licht sehen. Haie, Wale, Delfine und Robben sind farbenblind und besitzen nur einen grün-empfindlichen Zapfentyp.
Einmalig in der Augenentwicklung von Wirbeltieren ist die Wanderung eines der beiden Augen bei Plattfischen. Hierbei kann ein Auge während des frühen Wachstums an der Rückenflosse vorbei oder durch deren Basis hindurch auf die spätere obere Körperseite wandern. Die Wanderung kann sowohl auf die linke Seite (Steinbutt) als auch auf die rechte Seite (Scholle, Seezunge) verlaufen.[52]


Einige Wasserschildkröten, darunter die Falsche Landkarten-Höckerschildkröte (Graptemys pseudogeographica), können ihre Augen um eine gedachte Achse drehen, die die Pupillen verbindet (Abb. 16 und 17). Die Zentrallinie der Augen bleibt dadurch meist auf den Horizont ausgerichtet, auch wenn das Tier nach oben oder unten schwimmt und dabei in Schwimmrichtung blickt. Auf der Ebene der schwarzen Zentrallinie hat die Netzhaut die höchste Rezeptorendichte, somit ist das dicht am Boden oder im Wasser lebende Tier für das Sehen entlang der Horizontallinie am besten angepasst. Koordiniert wird diese einmalige Entwicklung vermutlich durch den Gleichgewichtssinn im Gehirn (Vestibularorgan), der spezifische Augenmuskeln dafür steuert.[53] Eine große Herausforderung stellt die Anpassung an Augen der Wirbeltiere, die sowohl unter als auch über Wasser gut sehen müssen, wie etwa das Vierauge. Seine Hornhaut entwickelt sich zweigeteilt: Die obere Hälfte ist stark gekrümmt für das Sehen über Wasser, die untere Hälfte nur sehr schwach gekrümmt für das Sehen unter Wasser (Abb. 16). So wird der unterschiedlichen Brechkraft von Luft und Wasser Rechnung getragen und gleichzeitiges gutes Sehen in Luft und Wasser möglich. Auch die Netzhaut des Vierauges entwickelt sich zweigeteilt. Die für das Sehen in der Luft zuständige Seite hat doppelt so viel Zapfen wie die für das Sehen im Wasser.[52]
Chamäleons entwickeln mehrere herausragende Eigenschaften ihrer Augen. Diese sind voneinander unabhängig beweglich. Man vermutet, dass es zu einer unabhängigen und getrennten Verarbeitung der Informationen beider Augen im Gehirn kommt. Chamäleons erzielen ferner durch die kleine Augenöffnung einen zusätzlichen Lochkameraeffekt, der es ihnen erlaubt, auf einen Kilometer scharf zu stellen. Ihre Fokussiergeschwindigkeit ist etwa viermal schneller als die des Menschen.[54] Weitere Besonderheiten bei Wirbeltieraugen sind die kugelförmige, im Ruhezustand auf kurze Distanz fokussierte Linse bei Fischen, multifokale Linsen bei manchen Katzenarten, die Schrägstellung der Netzhaut zur Linse bei Pferden, was einen Gleitsichteffekt bewirkt oder die schützende Nickhaut bei Fröschen, Vögeln und Hunden, rudimentär auch im nasenseitigen Augenwinkel beim Menschen.[52] Entwicklungsprozesse und Genetik der hier beschriebenen Augenkomponenten und -unterschiede bei Wirbeltieren sind erst wenig erforscht.
Chronologie wissenschaftlicher Entdeckungen zur Augenentwicklung
| Jahr | Forscher | Entdeckung |
|---|---|---|
| ca. 350 v. Chr. | Aristoteles[55] | Die Entstehung des Auges und anderer Organe ist nicht vorgeprägt (Präformation), sondern sie entstehen nacheinander, nach Art einer Kettenreaktion.[56] Verbindung des Auges mit dem Gehirn, Auge als Teil des Gehirns (beobachtet am Hühnchenembryo).[57] Verbindung Auge-Gehirn jedoch nicht als sinnesphysiologische Verbindung erkannt.[58] |
| 1660 | Edme Mariotte | Blinder Fleck |
| 1817 | Christian Heinrich Pander | Das optische Vesikel entstammt dem Vorderhirn |
| 1830 | Emil Huschke | Linse bildet sich aus Oberflächen-Ektoderm-Zellen |
| 1830 | Emil Huschke | Optischer Becher wird aus dem Vesikel gebildet |
| 1850–1855 | Robert Remak | Linsenhaut entwickelt sich aus dem Linsenvesikel |
| 1861 | Albert von Kölliker | Retina entsteht aus zwei Schichten des optischen Bechers |
| 1875 | Johannes Peter Müller | Die Fasern des Sehnervs beginnen in der Retina und wachsen bis ins Vorderhirn |
| 1895 | Gustav Wolff | Erste Beschreibung der Linsenregeneration durch Gewebetransformation aus der Iris beim Molch[59] |
| 1920 | Hans Spemann | Die Linseninduktion erfolgt durch das optische Vesikel |
| 1963 | R.W. Sperry[33] | Wachstum und Zielfindung der Augennervenfasern |
| 1992 | R.M. Grainger[17] | Linseninduktionsschritte: Von der Linsenkompetenz bis zu Linsenspezialisierung des Ektoderms |
| 1995 | Walter Jakob Gehring[4] | Entdeckung des Pax6-Gens als Schaltergen für alle Augentypen |
| 1999 | Robert L. Chow et al.[5] | Pax6-Gen wird als Induktor für das Auge beim Wirbeltier nachgewiesen |
| 2002 | A.K. Knecht & M. Bronner-Fraser[60] | Induktion der Neuralleiste als multigenetischer Prozess |
| 2002 | S. W. Wang et al.[24] | Regulation der Netzhaut-Zelldifferenzierung |
| 2003 | M. Zuber et al.[3] | Genregulationsnetzwerk für die Augenbildung relativiert die Alleinstellung von Pax6 |
| 2006 | M. Rembold, F. Loosli, J. Wittbrodt[15][61] | Individuelle Zellmigration im Gehirn veranlasst die Ausbildung des optischen Vesikels. |
| 2008 | P. Betancour, T. Sauka-Spengler & T.M. Bronner-Fraser[62] | Ein Genregulationsnetzwerk steuert die Formation der Neuralleiste |
| 2013 | S. Rao et al.[44] | Lichtreflexionen im Mutterleib aktivieren Melanopsin zur Bildung von Gefäßen und Neuronen |
Siehe auch
Literatur
- Jan Langman (Begr.), Thomas W. Sadler: Medizinische Embryologie. Die normale menschliche Entwicklung und ihre Fehlbildungen. 10. Auflage. Thieme Verlag, Stuttgart 2003, ISBN 3-13-446610-4.
Weblinks
- Online Animation der Augenentwicklung (Flash; 68 kB)
- Developmental origins of the eye
- PY4302 Developmental Neuroscience Eye Development – PowerPoint PPT Presentation
- Eye development auf YouTube (englisch)
- Bilder der frühen Ausbildung des Augenfelds bei Xenopus laevis durch Pax6-Rx1-Sox3-Expression auf der Neuralplatte
- Ein tiefer Einblick in die Evolution der Augen. Ein Masterkontrollgen kontrolliert die Entwicklung. Neue Zürcher Zeitung 7. Nov. 2001
- Zebrafisch: Augenenmorphogenese im Film
- University of the Basque Country Press (UBC Press): Eye Development. The International Journal of Developmental Biology Vol. 48 No. 8/9, (2004) S. 685–1058. Special Issue
- James F. Fadool, John E. Dowling: Zebrafish: A model system for the study of eye genetics (PDF; 2,1 MB)
Einzelnachweise
- Trevor D. Lamb, Shaun P. Collin, Edward N. Pugh Jr.: Evolution of the vertebrate eye: opsins, photoreceptors, retina and eye cup. In: Nature Reviews. 8, 2007, S. 960–975.
- Werner A. Müller, Monika Hassel: Entwicklungsbiologie und Reproduktionsbiologie von Mensch und Tieren. 5. Auflage. Springer Spektrum, 2012.
- Michael E. Zuber, Gaia Gestri, Andrea S. Viczian, Giuseppina Barsacchi and William A. Harris: Specification of the vertebrate eye by a network of eye field transcription factors. In: Development. 12/2003, 130, S. 5155–5167.
- Georg Halder, Patrick Callaerts, Walter J. Gehring: Induction of Ectopic Eyes by Targeted Expression of the eyeless Gene in Drosophila. In: Science. 267 (1995), S. 1788–1792.
- Robert L. Chow, Curtis R. Altmann, Richard A. Lang, Ali Hemmati-Brivanlou: Pax6 induces ectopic eyes in a vertebrate. In: Development. 126, 1999, S. 4213–4222.
- D. Uwanogho, M. Rex, E.J. Cartwright, G. Pearl, C. Healy, P.J. Scotting, P.T. Sharpe: Embryonic expression of the chicken Sox2, Sox3 and Sox11 genes suggests an interactive role in neuronal development Mech. In: Development. 49 (1995), S. 23–36.
- Reinhard W. Köste, Ronald P. Kühnlein, Joachim Wittbrodt: Ectopic Sox3 activity elicits sensory placode formation. In: Science direct. Volume 95, Issues 1–2, 1 July 2000, S. 175–187.
- Michael Kühl, Susanne Gessert: Entwicklungsbiologie. UTB Basics, 2010.
- Désirée White, Montserrat Rabago-Smith: Genotype–phenotype associations and human eye color. In: Journal of Human Genetics. 56, 5–7 (Januar 2011).
- Jesper Kronhamn, Erich Frei, Michael Daube, Renjie Jiao, Yandong Shi, Markus Noll, Åsa Rasmuson-Lestander: Headless flies produced by mutations in the paralogous Pax6 genes eyeless and twin of eyeless. In: Development. 129, 2002, S. 1015–1026.
- M. A. Serikaku, J.E. O’Tousa: Sine oculis is a homeobox gene required for Drosophila visual system development. In: Genetics. 1994 Dec;138(4), S. 1137–1150.
- Nancy M. Bonini*, Quang T. Bui, Gladys L. Gray-Board, John M. Warrick: The Drosophila eyes absent gene directs ectopic eye formation in a pathway conserved between flies and vertebrates. In: Development. 124, 1997, S. 4819–4826.
- T. A. Heanue, R. J. Davis, D. H. Rowitch, A. Kispert, A. P. McMahon, G. Mardon, C.J. Tabin: Dach1, a vertebrate homologue of Drosophila dachshund, is expressed in the developing eye and ear of both chick and mouse and is regulated independently of Pax and Eya genes. In: Mech Dev. 2002 Feb;111(1-2), S. 75–87.
- Chin Chiang, Ying Litingtung, Eric Lee, Keith E. Young, Jeffrey L Corden, Heiner Westphal, Philip A. Beachy: Cyclopia and defective axial patterning in mice lacking Sonic hedgehog gene function. In: Nature. 383 (6599) (1996), S. 407–413. doi:10.1038/383407a0. PMID 8837770
- M. Rembold, F. Loosli, R. J. Adams, J. Wittbrodt: Individual cell migration serves as the driving force for optic vesicle evagination. In: Science. 2006 Aug 25;313(5790), S. 1130–1134.
- Ein wanderndes Auge. Das Biotechnologie und Life Sciences Portal Baden-Württemberg 2006 (Memento vom 26. September 2013 im Internet Archive)
- R. M. Grainger: Embryonic lens induction: Shedding light on vertebrate tissue determination. In: Transgen. 8, 1992, S. 349–355.
- Bertram Schnorr, Monika Kressin: Embryologie der Haustiere. 6. Auflage. Enke.
- Nick Lane: Leben – Verblüffende Erfindungen der Evolution. Kap. 7: Sehen. Primus Verlag, 2013.
- Faszination Lebenswissenschaften. Wiley-VCH, 2002.
- Renate Lüllmann-Rauch, Friedrich Paulsen: Taschenbuch der Histologie. 4. Auflage. Thieme, Stuttgart.
- Égouchi, Goro u. a. Regenerative capacity in newts is not altered by repeated regeneration and ageing. Nature Communication, 2011, July 2, 384
- Leon S. Stone: Regeneration of the Lens, Iris, and Neural Retina in a Vertebrate Eye. In: Yale J Biol Med. 1960 June; 32(6), S. 464–473.
- S. W. Wang, X. Mu, W. J. Bowers, W. H. Klein: Retinal ganglion cell differentiation in cultured mouse retinal explants. In: Methods. 2002 Dec;28(4), S. 448–456.
- M. J. Belliveau, C. L. Cepko: Extrinsic and intrinsic factors control the genesis of amacrine and cone cells in the rat retina. In: Development. 1999 Feb;126(3), S. 555–566.
- C. J. Neumann, C. Nüsslein-Volhard: Patterning of the zebrafish retina by a wave of sonic hedgehog activity. In: Science. 289(5487), S. 2137–2139.
- Alena Shkumatava, Sabine Fischer, Ferenc Müller, Uwe Strahle, Carl J. Neumann: Sonic hedgehog, secreted by amacrine cells, acts as a short-range signal to direct differentiation and lamination in the zebrafish retina. In: Development. 131, 2004, S. 3849–3858.
- S. J. Isenberg: Macular development in the premature infant. In: Am J Ophthalmol. 1986 Jan 15;101(1), S. 74–80.
- Linda Conlin: Embryonic Eye Development. Nov.2012
- W. Westheide; R. M. Rieger; G. Rieger; G. Rieger (Hrsg.): Spezielle Zoologie. Teil 2: Wirbel- oder Schädeltiere. 2. Auflage. Springer Verlag, 2010, ISBN 978-3-8274-2039-8, S. 100.
- Johannes W. Rohen, Elke Lütjen-Drecoll: Funktionelle Histologie. 4. Auflage. Schattauer, F.K. Verlag, 2000, ISBN 3-7945-2044-0, S. 476.
- Jan Zrzavý, Hynek Burda, David Storch, Sabine Begall, Stanislav Mihulka: Evolution: Ein Lese-Lehrbuch. 2. Auflage. Springer Verlag, Berlin, Heidelberg 2013, ISBN 978-3-642-39695-3, S. 258.
- R.W. Sperry: Chemoaffinity in the Orderly Growth of Nerve Fiber patterns and Connections. In: Proc. Natl. Acad. Sci. (USA), 50 (1963), S. 703–710.
- D.D. O’Leary, D.G. Wilkinson: Eph receptors and ephrins in neural development. In: Curr Opin Neurobiol. 1999 Feb;9(1), S. 65–73.
- M. Jacobson: Retinal ganglion cells: specification of central connections in larval Xenopus laevis. In: Science. 1967 Mar 3;155(3766), S. 1106–1108.
- nach Wolfgang Maier: Kopf. In: W. Westheide, R. Rieger (Hrsg.): Spezielle Zoologie. Teil 1: Einzeller und Wirbellose Tiere. Gustav Fischer, Stuttgart / Jena 1997, 2004, ISBN 3-8274-1482-2, S. 32.
- Hildebrand, Milton und Goslow, George: Vergleichende und funktionelle Anatomie der Wirbeltiere. Englische Originalausgabe erschienen bei John Whiley & Sons, USA, 2001, ISBN 3-540-00757-1, S. 204 ff.
- Jan Langman (Begr.), Thomas W. Sadler: Medizinische Embryologie. Die normale menschliche Entwicklung und ihre Fehlbildungen. 10. Auflage. Thieme Verlag, Stuttgart 2003, ISBN 3-13-446610-4, S. 172 ff.
- Herbert Kaufmann: Strabismus. 4. grundlegend überarbeitete und erweiterte Auflage. unter Mitarbeit von W. de Decker u. a. Georg Thieme Verlag, Stuttgart / New York 2012, ISBN 978-3-13-129724-2.
- Inge Flehmig: Normale Entwicklung des Säuglings und ihre Abweichungen : Früherkennung und Frühbehandlung. Georg Thieme Verlag, 2007. ISBN 9783135606071
- Walther Grauman, Dieter Sasse: CompactLehrbuch der gesamten Anatomie 04: Sinnessysteme, Haut, ZNS, Periphere Leitungsbahnen. 1. Auflage. Band 4, Schattauer Verlag, 2004, ISBN 3-7945-2064-5.
- Martina Ibounigg: Spezielle Embryologie. GRIN Verlag, München 2001, ISBN 3-638-98508-3, doi:10.3239/9783638985086
- R. W. Dudek, J. D. Fix: Eye. In: Embryology – Board Review Series. 3. Auflage. Lippincott Williams & Wilkins, 2004, ISBN 0-7817-5726-6, S. 92.
- Sujata Rao, Christina Chun, Jieqing Fan, J. Matthew Kofron, Michael B. Yang, Rashmi S. Hegde, Napoleone Ferrara, David R. Copenhagen, Richard A. Lang: A direct and melanopsin-dependent fetal light response regulates mouse eye development. In: Nature. 494, S. 243–246 (14 February 2013)
- Herbert Kaufmann: Strabismus. 4. grundlegend überarbeitete und erweiterte Auflage. unter Mitarbeit von W. de Decker u. a., Georg Thieme Verlag, Stuttgart / New York 2012, ISBN 978-3-13-129724-2.
- Barbara Käsmann-Kellner: Entwicklung des Sehens im Kindesalter – Amblyopie und Screening (Memento vom 29. Oktober 2013 im Internet Archive) Universitäts-Augenklinik Homburg. (PDF; 3,8 MB)
- G. Bargsten: Persistent remnants of the pupillary membrane in adult rats of different strains. Zeitschrift für Versuchstierkunde, 30 (1987), S. 117–121.
- Paul Simoens: Sehorgan, Organum visus. In: Franz-Viktor Salomon, Hans Geyer, Uwe Gille (Hrsg.): Anatomie für die Tiermedizin. 2., überarbeitete und erweiterte Auflage. Enke, Stuttgart u. a. 2008, ISBN 978-3-8304-1075-1, S. 579–612.
- O.-E. Lund, B. von Barsewisch: Die Macula in der Tierreihe. Erkrankungen der Macula. In: Deutsche Ophthalmologische Gesellschaft. Volume 73, 1975, S. 11–17. Springer
- S. G. Kiama, J. N. Maina, J. Bhattacharjee, K. D. Weyrauch: Functional morphology of the pecten oculi in the nocturnal spotted eagle owl (Bubo bubo africanus), and the diurnal black kite (Milvus migrans) and domestic fowl (Gallus gallus var. domesticus): a comparative study. In: Journal of Zoology. 254 (2001), S. 521–528.
- Timothy H. Goldsmith, Vögel sehen die Welt bunter. In: Spektrum der Wissenschaft. Januar 2007, S. 96–103; → Spektrum und (PDF)
- Georg Glaeser, Hannes F. Paulus: Die Evolution des Auges. Springer-Spektrum 2014.
- Kenneth T. Brown: A linear area centralis extending across the turtle retina and stabilized to the horizon by non-visual cues. In: Vision Research. 10/1969; 9(9), S. 1053–1062.
- A. Herrel, J. J. Meyers, P. Aerts, K. C. Nishikawa: The Mechanics of prey prehension in chameleons. In: Journal of Experimental Biology. 203 (2000), S. 3255–3263.
- Aristotels, Naturgeschichte der Tiere; 3: Buch 6-8, Vol.6, Nabu Press 2012 (Historia animalium)
- Horst Seidl: Beiträge zu Aristoteles' Naturphilosophie. (= Elementa Texte. 5). Editions Rodopi, 1995, S. 146.
- Carolin M. Oser-Grote: Das Auge und der Sehvorgang bei Aristoteles und der hippokratischen Schrift De carnibus. In: Wolfgang Kullmann (Hrsg.): Aristotelische Biologie : Intentionen, Methoden, Ergebnisse. Steiner, Stuttgart 1997, ISBN 3-515-07047-8, S. 339.
- Carolin M. Oser-Grote: Das Auge und der Sehvorgang bei Aristoteles und der hippokratischen Schrift De carnibus. In: Wolfgang Kullmann (Hrsg.): Aristotelische Biologie : Intentionen, Methoden, Ergebnisse. Steiner, Stuttgart 1997, ISBN 3-515-07047-8, S. 340.
- Gustav Wolff: Entwicklungsphysiologische Studien. Teil I: Die Regeneration der Urodelenlinse. In: Roux Arch. Entw. Mech. Org. 1, S. 280–390.
- A. K. Knecht, M. Bronner-Fraser: Induction of the neural crest: a multigene process. In: Nat Rev Genet. 2002 Jun;3(6), S. 453–461.
- Ein wanderndes Auge. Das Biotechnologie und Life Sciences Portal Baden-Württemberg 2006 (Memento vom 26. September 2013 im Internet Archive)
- Paola Betancur, Marianne Bronner-Fraser, Tatjana Sauka-Spengler: Assembling Neural Crest Regulatory Circuits into a Gene Regulatory Network. In: Annual Review of Cell and Developmental Biology. Vol. 26, S. 581–603.