Arecaidin
Arecaidin ist eine heterocyclische Carbonsäure und ein tertiäres Amin, das neben dem Methylester (Arecolin) in den Steinkernen der Früchte der Betelnusspalme (Areca catechu) vorkommt.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
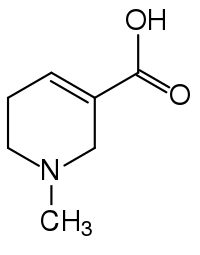 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Arecaidin | ||||||||||||
| Andere Namen |
1-Methyl-1,2,5,6-tetrahydropyridin-3-carbonsäure (IUPAC) | ||||||||||||
| Summenformel | C7H11NO2 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 141,17 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
sehr leicht löslich in Wasser, fast unlöslich in Diethylether, Benzol, Chloroform.[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Entdeckung
Bei Forschungen über stickstoffhaltige Pflanzeninhaltsstoffe (Alkaloide) entdeckte der Apotheker Ernst Friedrich Jahns um 1890 diese Substanz in Betelnüssen. Jahns konnte die Verbindung auch synthetisieren, womit damals der Beweis für die Konstitution erbracht wurde. Dazu wurde das Kaliumsalz der Nicotinsäure mit Methyliodid in einem Bombenrohr auf 150 °C erhitzt. Es bildete sich das „Jodmethylat“ des Nicotinsäuremethylesters; das Iodid-Ion dieses Pyridiniumsalzes wurde durch Behandlung mit Silberchlorid gegen das Chlorid-Ion getauscht. Die Reduktion des Pyridiniumchlorids mit Zinn und Salzsäure ergab eine Tetrahydropyridincarbonsäure. Die Lage der C=C-Doppelbindung war jedoch damit nicht bewiesen.[3]
Synthesen
Alfred Wohl und sein Schüler A. Johnson synthetisierten die Verbindung ausgehend von Methylamin, an dessen Stickstoffatom zwei gleichartige C3-Substituenten mit maskierter Aldehyd-Funktion angefügt wurden. Bei der sauren Hydrolyse (Salzsäure) entstand das Hydrochlorid des der Carbonsäure entsprechenden Aldehyds. Diese Zwischenstufe wurde über das Oxim und das Nitril in Arecaidin-Hydrochlorid umgewandelt. Durch diese unkonventionelle – nach heutigem Wissen aber umständliche – Synthese musste Arecaidin die C=C-Doppelbindung zwischen C-3 und C-4 des Piperidinrings besitzen.[4]

Eine einfachere Synthese wurde in den 1950er Jahren von Nikolai Alekseevich Preobraschenski (1896–1976) und Mitarbeitern erarbeitet.[5] Mit dem Ziel, Arecolin herzustellen, setzten die russischen Forscher Acrylsäuremethylester mit Methylamin um, wodurch ein 4-Azaheptandisäuredimethylester erhalten wurde. Durch Dieckmann-Kondensation wurde der Ringschluss zum Piperidinon erreicht, dessen Carbonylgruppe anschließend hydriert, d. h. reduziert wurde. Dehydratisierung führte zum Arecaidin.

Chemische Eigenschaften
Als Carbonsäure mit basischer tertiärer Aminogruppe muss Arecaidin eine zwitterionische Struktur bilden können. Dafür spricht der relativ hohe Schmelzpunkt des Feststoffes und die sehr geringe Löslichkeit in Benzol, Chloroform und Diethylether. Eine 0,1 molare Lösung in Wasser zeigt einen pH-Wert von 5,6.[1]
Verwendung
Vermutlich hat Arecaidin keine chemische oder pharmakologische Bedeutung, sondern muss lediglich als Stammverbindung seiner Derivate, z. B. Arecolin, betrachtet werden.
Einzelnachweise
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 11. Auflage. Rahway, N.J. 1989, ISBN 0-911910-28-X, S. 122 (englisch).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- E. Jahns: Über die Alkaloide der Arecanuß. In: Archiv der Pharmazie. Bd. 229, 1891, S. 669–704, doi:10.1002/ardp.18912290812.
- A. Wohl, A. Johnson: Über Arecaidin und Arecolin. In: Berichte der deutschen chemischen Gesellschaft. Band 40, Nr. 4, 1907, S. 4712–4719, doi:10.1002/cber.190704004119.
- N. A. Preobrazhensky, K. M. Malkow, M. E. Maurit, M. A. Vorobyev, A. S. Vlazov: Synthesis of Alkaloid Arecoline and its Homologs. In: Journal of General Chemistry of the USSR (englische Übersetzung). Bd. 27, 1957, S. 3200–3206.