Apocynin
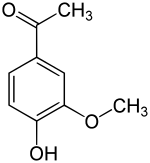
Apocynin (meist auch Acetovanillon, 4-Hydroxy-3-methoxyacetophenon) ist eine organisch-chemische Verbindung mit der Summenformel C9H10O3, die sich strukturell sowohl vom Acetophenon als auch vom Guajacol (o-Methoxyphenol) ableitet. Es ist ein Derivat des Acetophenons mit einer zusätzlichen Hydroxy- und einer Methoxygruppe als Substituenten. Es zählt ferner strukturell zu den Verwandten des Vanillins. Es wurde aus einer Vielzahl von pflanzlichen Quellen isoliert und wird auf seine zahlreichen pharmakologischen Eigenschaften hin untersucht.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Acetovanillon | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C9H10O3 | |||||||||||||||||||||
| Kurzbeschreibung |
weiße Nadeln[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 166,18 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Löslichkeit |
löslich in heißem Wasser sowie Ethanol, Ether, Chloroform und Benzol[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Im biologisch-pharmazeutischen Umfeld wird eher die Bezeichnung Apocynin verwendet, in der Chemie aufgrund seiner strukturellen Verwandtschaft mit Vanillin eher Acetovanillon.
Geschichte

Apocynin wurde zuerst von dem deutschen Pharmakologen Oswald Schmiedeberg im Jahre 1883 beschrieben und zum ersten Mal aus der Wurzel des Indianischen Hanfs oder Kanadischen Hanfs (Apocynum cannabinum) isoliert.[5] Zu dieser Zeit war diese Pflanze bereits für ihre Wirksamkeit gegen Ödeme und Herzbeschwerden bekannt.[6]
1891 veröffentlichte Ferdinand Tiemann seine Arbeiten über die Isolierung von Acetovanillon. Durch ihn erfolgte auch die Namenswahl: … das Acetovanillon steht zum Vanillin genau in demselben Verhältniss wie das Acetophenon zum Benzaldehyd. Dieser Analogie Rechnung tragend habe ich die Verbindung Acetovanillon genannt und ihre Derivate dementsprechend bezeichnet.[1] In der unmittelbar von Erich Neitzel folgenden Arbeit kommt diese Namenswahlanalogie für die Derivate zur Anwendung, z. B.: Acetoveratron (3,4-Dimethoxyacetophenon, abgeleitet vom Veratrumaldehyd) und Acetoprotocatechon (3,4-Dihydroxyacetophenon, abgeleitet vom Protocatechualdehyd).[7][3] Th. Otto beschreibt wiederum im anschließenden Folgeartikel die Synthese durch Umsetzung von Guajacol mit Eisessig in Gegenwart von Zinkchlorid und Aluminiumchlorid:[8]
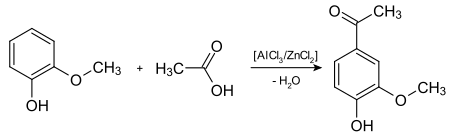
Finnemore wandte sich 1908 erneut der Isolierung zu und verbesserte dabei das Verfahren und die Ausbeute. Er zeigte ferner, dass Apocynin und das 1891 von Otto synthetisierte Acetovanillon die gleiche Substanz sind.[9]
Im Jahr 1971 wurde Apocynin auch aus Picrorhiza kurroa, einer kleinen Pflanze, die in großen Höhen im westlichen Himalaya wächst, isoliert.[10] P. kurroa wurde zeitweise zur Behandlung von Leber- und Herzproblemen, Gelbsucht und Asthma verwendet. Apocynin besitzt entzündungshemmende Eigenschaften und verhindert die Bildung freier Radikale, Sauerstoff-Ionen und Peroxide im Körper.[11] Apocynin wurde seitdem auf seine Eigenschaften und Anwendbarkeit im Kampf gegen Krankheiten eingehend untersucht.
Eigenschaften
Acetovanillon bildet weiße Nadeln[1] und ist löslich in heißem Wasser sowie Ethanol, Ether, Chloroform und Benzol.[3] Es schmilzt bei 112–115 °C[2] und siedet bei 295–300 °C bei Normaldruck[1] bzw. 263–265 °C bei Unterdruck (17 mmHg; ≈ 23 hPa).[2] Eine wässrige Lösung von Eisen(III)-chlorid bildet mit Acetovanillon eine intensiv blauviolette Farbe.[3]
Als struktureller Verwandter des Vanillins ist es Bestandteil von Vanillinaromen. Das auf Lignin-Basis gewonnene Vanillearoma besitzt ein reicheres Geschmacksprofil. Dies ist auf die Anwesenheit von Acetovanillon (Apocynin) als Lignin-Folgeprodukt zurückzuführen – eine Verunreinigung, die in Vanillin aus einer Guajacolsynthese nicht auftritt.[12]
Isomere
iso-Acetovanillon (3-Hydroxy-4-methoxyacetophenon)[13] unterscheidet sich vom Acetovanillon durch die Stellung der Methoxygruppe. Anstatt an Position 3 ist diese hier an Position 4 vorzufinden. Hydroxy- und Methoxygruppe tauschen im Vergleich zum Acetovanillon die Plätze. Die Strukturanalogie entspricht der zwischen Vanillin und Isovanillin.
ortho-Acetovanillon (2-Hydroxy-3-methoxyacetophenon)[14] unterscheidet sich vom Acetovanillon durch die Stellung der Hydroxygruppe. Die Vorsilbe ortho- kennzeichnet hier die Position der Hydroxygruppe in Bezug zur Acetylgruppe; im Acetovanillon befinden sich diese beiden Gruppen in para-Stellung. Die Strukturanalogie entspricht der zwischen Vanillin und ortho-Vanillin.
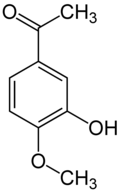 iso-Acetovanillon
iso-Acetovanillon Acetovanillon
Acetovanillon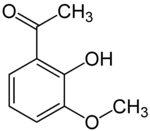 ortho-Acetovanillon
ortho-Acetovanillon
Pharmakologie
Apocynin ist ein Hemmstoff (Inhibitor) der NADPH-Oxidase (Nox). Dieses membrangebundene Enzym findet sich u. a. an Phagosomen und reduziert Sauerstoff (O2) zu Hyperoxid (O2−·) unter Verbrauch von NAD(P)H. Hyperoxid gehört zu den reaktiven Sauerstoffspezies (ROS) und wird im Zuge der Immunabwehr von Leukozyten und Granulozyten gebildet, um Bakterien und Pilze abzutöten. Durch Apocynin wird damit selektiv die NADPH-Oxidase inhibiert, ohne andere immunspezifische Aufgaben zu beeinflussen.
Darüber hinaus wurde die Spezifität von Apocynin als selektiver Inhibitor der NADPH-Oxidase anhand einer Studie bei Nierenmarkzellen aufgezeigt. In jenen Gewebezellen wird durch einen Protonenausstrom die NADPH-Oxidase aktiviert.[15] Apocynin jedoch inhibiert dieses Enzym spezifisch, ohne den Protonenfluss zu beeinflussen.
Fallbeispiele einer möglichen therapeutischen Wirkung:
- Neutrophile Granulozyten spielen bei der Erkrankung von kollageninduzierter Arthritis eine entscheidende Rolle. Außerdem sind sie beim Ausprägen von Entzündungsreaktionen der Gelenke involviert. Durch Apocynin soll die Menge dieser Granulozyten reduziert werden. Eine bereits bestehende Entzündung kann jedoch nicht wieder rückgängig gemacht werden.[16]
- In klinischen Studien zeigt Apocynin bei Ratten mit chronisch-entzündliche Darmerkrankungen eine Verminderung der Schädigung des Darms. Zudem wird die enzymatische Aktivität der Myeloperoxidase gesenkt, die an der Entzündungsreaktion bei einer Erkrankung beteiligt ist. Schließlich senkt Apocynin auch die Menge an Makrophagen und Granulozyten im Darm.[17]
- Androsen, das Glucosid von Apocynin, scheint bei der Behandlung von Asthmaerkrankungen eine Wirkung zu zeigen. So wird bei Meerschweinchen eine Verengung der Bronchien verhindert. Möglicherweise hemmt Apocynin die Entstehung von gewissen Entzündungsprozessen.[18]
- Bei der Behandlung von Arteriosklerose könnte Apocynin eingesetzt werden, um die Aktivität der NADPH-Oxidase zu hemmen. Dadurch werden weniger ROS erzeugt, welche endotheliale Zellen schädigen.[19]
- Bei Patienten mit amyotrophe Lateralsklerose (ALS), einer degenerativen Erkrankung des motorischen Nervensystems, wurden häufig verschiedene Mutationen im Gen der Superoxiddismutase (SOD-1) gefunden, welche Hyperoxid zu Wasserstoffperoxid (H2O2) und O2 disproportioniert. Die Lebensspanne von ALS-erkrankten Mäusen mit einem derart defekten SOD-1-Gen wird durch Trinkwasser verabreichtes Apocynin erhöht. Außerdem wird spezifisch die Toxizität von Gliazellen in Zellkulturen mit einem defekten SOD-1-Gen durch Apocynin reduziert. Diese Toxizität wird dadurch hervorgerufen, dass Hyperoxide durch NADPH-Oxidasen (Nox) in Gliazellen erzeugt werden.
Möglicherweise dient SOD-1 als selbstregulierender Redoxsensor gegenüber Hyperoxid, was durch die NADPH-Oxidase generiert wird. Obwohl beim Menschen Apocynin septische Granulomatose verursacht, könnten – zunächst bei Mäusen – auf der Basis dieser Ergebnisse neue Medikamente bei der Therapie gegen ALS entwickelt werden.[20]
Literatur
- Cees J. Beukelman, Edwin van den Worm, C. Henriette, Q. van Ufford, Burt H. Kroes, Albert J. J. van den Berg: Discovery of new anti-inflammatory drugs from plant origin. In: Annals of Gastroenterology, 2002, 15(4), S. 320–323; Abstract; PDF.
- J. Stefanska, R. Pawliczak: Apocynin: Molecular Aptitudes. In: Mediators of Inflammation, 2008; Article ID 106507, 10 pages; doi:10.1155/2008/106507.
- E. Worm: Apocynin: A tiny, but mighty molecule. (PDF; 547 kB) 2001.
Einzelnachweise
- Ferd. Tiemann: Ueber Acetovanillon. In: Berichte der deutschen chemischen Gesellschaft, 1891, 24(2), S. 2855–2862; doi:10.1002/cber.189102402110.
- Datenblatt 4′-Hydroxy-3′-methoxyacetophenone bei Sigma-Aldrich, abgerufen am 9. November 2012 (PDF).
- Erich Neitzel: Ueber Derivate des Acetovanillons. In: Berichte der deutschen chemischen Gesellschaft, 1891, 24(2), S. 2863–2868; doi:10.1002/cber.189102402111.
- Eintrag zu Acetovanillone in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- Otto Schmiedeberg: Über die wirksamen Bestandtheile der Wurzel von Apocynum canabinum L. In: Arch. Exp. Path. Pharm., 1883, 16, S. 161–164.
- H. C. Wood: A study of Apocynum cannabinum. In: J. Am. Med. Assoc., 1904, 43, S. 1953–1957; doi:10.1001/jama.1904.92500260002f.
- Erich Neitzel: Das Acetovanillon und seine Derivate. Dissertation. Berlin 1890; Druck v. Thormann & Goetsch; 40 S. + 2 Bl.
- Th. Otto: Ueber die Synthese des Acetovanillons aus Guajacol und Eisessig. In: Berichte der deutschen chemischen Gesellschaft, 1891, 24(2), S. 2869–2870; doi:10.1002/cber.189102402112.
- H. Finnemore: The constituents of Canadian hemp; Part I: Apocynin. In: J. Chem. Soc., 1908, 93, S. 1513–1520; doi:10.1039/CT9089301513.
- K. Basu, B. Das Gupta, S. K. Bhattacharya, P. K. Debnath: Chemistry and pharmacology of apocynin, isolated from Picrorhiza kurroa Royle ex Benth. In: Current Science, 1971, 40(22), S. 603–604.
- Jos M. Simons, Bert A. 't Hart, Theo. R. A. M. Ip Vai Ching, Hans van Dijk, Rudi P. Labadie: Metabolic activation of natural phenols into selective oxidative burst agonists by activated human neutrophils. In: Free Radical Biology and Medicine, 1990, 8(3), S. 251–258; doi:10.1016/0891-5849(90)90070-Y; PMID 2160411.
- Lawrence J. Esposito, K. Formanek, G. Kientz, F. Mauger, V. Maureaux, G. Robert, F. Truchet: Vanillin, Kirk-Othmer Encyclopedia of Chemical Technology, 4th edition, Vol. 24. John Wiley & Sons, New York 1997, S. 812–825.
- Wilhelm Schneider, Edgar Kraft: Sulfo-essigsäure als Kondensationsmittel, IV.: Iso-acetovanillon. In: Berichte der deutschen chemischen Gesellschaft, 1922, 55(6), S. 1892–1899; doi:10.1002/cber.19220550640.
- Tadeus Reichstein: Acetovanillon, iso- und ortho-Acetovanillon. (Ein Fall von Acylwanderung nach Meta-Stellung). In: Helvetica Chimica Acta, 1927, 10(1), S. 392–397; doi:10.1002/hlca.19270100147.
- N. Li, G. Zhang, F. X. Yi, A. P. Zou, P. L. Li: Activation of NAD(P)H oxidase by outward movements of H+ ions in renal medullary thick ascending limb of Henle. In: Am J Physiol Renal Physiol., 2005, 289(5), S. F1048–F1056; PMID 15972387.
- Bert A. ’t Hart, Jos M. Simons, Shoshan Knaan-Shanzer, Nicolaas P. M. Bakker, Rudi P. Labadie: Antiarthritic activity of the newly developed neutrophil oxidative burst antagonist apocynin. In: Free Radical Biology and Medicine, 1990, 9(2), S. 127–131; doi:10.1016/0891-5849(90)90115-Y; PMID 2172098.
- M. J. H. J. Palmen, C. J. Beukelman, R. G. M. Mooij, A. S. Peña, E. P. von Rees: Anti-inflammatory effect of apocynin, a plant-derived NADPH oxidase antagonist, in acute experimental colitis. In: The Netherlands Journal of Medicine, 1995, 47(2), S. A41; doi:10.1016/0300-2977(95)97051-P.
- Edwin van den Worm, Cees J. Beukelman, Albert J. J. van den Berg, Burt H. Kroes, Rudi P. Labadie, Hans van Dijk: Effects of methoxylation of apocynin and analogs on the inhibition of reactive oxygen species production by stimulated human neutrophils. In: Eur. J. Pharmacol., 2001, 433(2–3), S. 225–230; doi:10.1016/S0014-2999(01)01516-3; PMID 11755156.
- Elisabeth A. Peters, Jeroen T. N. Hiltermann, Jan Stolk: Effect of apocynin on ozone-induced airway hyperresponsiveness to methacholine in asthmatics. In: Free Radical Biology and Medicine, 2001, 31(11), S. 1442–1447; doi:10.1016/S0891-5849(01)00725-0; PMID 11728816.
- Maged M. Harraz, Jennifer J. Marden, Weihong Zhou, Yulong Zhang, Aislinn Williams, Victor S. Sharov, Kathryn Nelson, Meihui Luo, Henry Paulson, Christian Schöneich, John F. Engelhardt: SOD1 mutations disrupt redox-sensitive Rac regulation of NADPH oxidase in a familial ALS model. In: J. Clin. Invest., 2008, 118(2), S. 659–670; PMID 18219391; PMC 2213375 (freier Volltext).
