Hominisation
Als Hominisation (auch Anthropogenese, selten Anthropogenie) wird die evolutive Herausbildung des Merkmalsgefüges bezeichnet, das für den anatomisch modernen Menschen (Homo sapiens) charakteristisch ist.

Im Verlauf der Hominisation haben sich sowohl seine körperlichen Eigenschaften als auch seine geistigen Fähigkeiten herausgebildet. Hierzu gehören insbesondere der aufrechte Gang, das Gebiss mit verkürztem, parabolischem Zahnbogen und kleinen Eckzähnen sowie der späte Eintritt der Geschlechtsreife; ferner die Vergrößerung des Gehirns und die hiermit verbundenen kulturellen und sozialen Fähigkeiten, die heute lebende Menschen und deren Vorfahren von den anderen Menschenaffen unterscheiden.
Anhand von Fossilfunden und molekularbiologischen Datierungen wird der Beginn der Hominisation in die Zeit vor 7 bis 5 Millionen Jahren datiert, als sich die Entwicklungslinie der Schimpansen von der zum Menschen führenden Entwicklungslinie der Hominini trennte.
Auch in der Gegenwart ist die Evolution des Menschen nicht zum Stillstand gekommen.[1][2][3][4][5]
Anatomische Besonderheiten und Verhalten
Die folgenden Merkmale unterscheiden, dem US-amerikanischen Anatomen C. Owen Lovejoy zufolge, den anatomisch modernen Menschen (den Homo sapiens) von den anderen Arten der Menschenaffen: der aufrechte Gang, ein großer Neocortex (ein Bereich der Großhirnrinde), verkleinerte Schneidezähne und Eckzähne, ein einzigartiges sexuelles und reproduktives Verhalten sowie materielle Kultur.[6] Chris Stringer verwies ferner auf einen großen, rundlichen Schädel (bedingt durch das stark gewölbte Scheitelbein), allenfalls sehr kleine Überaugenwülste und einen Knochenvorsprung (das Kinn) am Unterkiefer.[7]
Leslie Aiello nannte 2014 folgende Merkmale: „großer, gradliniger Oberkörper, verlängerte Beine, großes Gehirn, verringerter Sexualdimorphismus, verstärkter Fleischkonsum, einzigartige Merkmale der Lebensgeschichte (z. B. verlängerte Embryonal- und Fötalphase sowie Langlebigkeit), ferner Herstellung von Werkzeugen und gesteigerte soziale Kooperation.“[8] Große genetische und morphologische Unterschiede im Vergleich mit Schimpansen weist ferner die Haut auf.[9]
Eines der ältesten menschenähnlichen anatomischen Merkmale ist die Gestalt des Amboss im Mittelohr, die bereits für Australopithecus africanus und Paranthropus robustus belegt ist und sich vermutlich schon bei deren letztem gemeinsamen Vorfahren von der Gestalt des Amboss bei den Schimpansen unterschied.[10] Die Brustwirbelsäule bestand bereits beim 3,3 Millionen Jahre alten Fossil DIK 1-1, einem jugendlichen Australopithecus afarensis, wie bei den meisten späteren Hominini aus 12 Wirbeln und nicht, wie bei den meisten Schimpansen, aus 13 Wirbeln.[11]
Ein Vergleich von Skelettfunden des frühen Homo aus unterschiedlichen Regionen Afrikas und Georgiens – ohne Berücksichtigung ihrer Zuordnung zu bestimmten Arten – ergab Hinweise auf erhebliche regionale Größen- und Gewichtsunterschiede (siehe Tabelle).[12]
| Fundort und Alter[12] | Körpergröße | Körpergewicht |
|---|---|---|
| Koobi Fora, jünger als 1,7 mya | 157 – 178 cm | 60 – 81 kg |
| Südafrikanische Höhlen, 1,8 bis 1,4 mya | 136 – 159 cm | 32 – 62 kg |
| Olduvai-Schlucht, 1,75 mya | 134 – 162 cm | 38 – 65 kg |
| Dmanissi, 1,8 mya | 147 – 153 cm | 46 – 53 kg |
| Koobi Fora, älter als 1,8 mya | 148 – 168 cm | 39 – 68 kg |
Ungeklärt ist bislang die Frage, warum sich die zum Menschen führende Entwicklungslinie von jener getrennt hat, die zu den Schimpansen führte. Der polnische Humanbiologe Bogusław Pawłowski bezeichnete dies als „eines der größten Rätsel der menschlichen Evolution“.[13]
Aufrechter Gang

links: Australopithecus (3,6 Mio. Jahre alt)
Mitte: Homo erectus (1,5 Mio. Jahre alt)
rechts: anatomisch moderner Mensch
Anhand der Skelettmerkmale zahlreicher Fossilfunde konnte belegt werden, dass sich der aufrechte, zweibeinige Gang (Bipedie) in der Familie der Menschenaffen deutlich früher entwickelte als die starke Vergrößerung des Gehirns.[14] C. Owen Lovejoy bezeichnete 1988 den Übergang zum aufrechten Gang als die augenfälligste Veränderung der Anatomie, die man in der gesamten Evolutionsbiologie bisher nachgewiesen habe.[15]
Richard Leakey zufolge ist diese Veränderung derart einzigartig, „dass wir berechtigt sind, alle Arten von zweibeinigen Menschenaffen als menschlich [human] zu bezeichnen.“[16] Eine so weitgehende Festlegung ist allerdings in Fachkreisen umstritten, da nicht alle Fossilfunde von zumindest zeitweise aufrecht gehenden, menschenaffen-ähnlichen Individuen der unmittelbaren Vorfahrenreihe des Menschen zuzuordnen sind[17] und sich der aufrechte Gang demnach mehrfach unabhängig voneinander im Formenkreis der Menschenaffen entwickelt zu haben scheint.[14]
Möglich war dies, weil bereits im mittleren Miozän – vor rund 10 Millionen Jahren – bei den Vorfahren der Menschenaffen die zuvor arborikal-quadrupede (vorwärts geneigt und vierbeinig über Ästen schreitende) Fortbewegungsweise in eine suspensorische (unter den Ästen hangelnde) Fortbewegungsweise übergegangen war, was eine allmählich fortschreitende Umgestaltung von Armen, Beinen und Rumpfskelett zur Voraussetzung hatte. Diese Umgestaltung, die bei vielen Primaten-Arten des Miozäns nachweisbar ist, gilt wiederum als bedeutende Voranpassung für den späteren Übergang zu einer bodenlebenden, zweibeinig-aufrechten Fortbewegungsweise.[18] Die markantesten Veränderungen am Fuß betrafen Bau und Zusammenspiel der Zehen- und Mittelfußknochen, die ursprünglich ein Greiforgan waren.[19] Merkmale des Innenohrs von Lufengpithecus (L. lufengensis) – eines frühen Menschenaffen – wurden 2024 ebenfalls als Beleg dafür interpretiert, dass die letzten gemeinsamen Vorfahren der heute lebenden Menschenaffen vor rund 8 Millionen Jahren sowohl in Bäumen umherklettern als auch sich – an den Armen unterhalb von Ästen hängend – hangelnd fortbewegen konnten, zudem zweibeinig in Bäumen stehen und zumindest zeitweise sich vierbeinig auf dem Boden fortbewegen konnten.[20]
Aus dem Knochenbau von Fossilien wie „Little Foot“ und „Lucy“ konnte abgeleitet werden, dass schon die Individuen der Gattung Australopithecus über größere Strecken hinweg aufrecht gehen konnten. Bestätigt wurde diese Interpretation 1979, als in Laetoli 3,6 Millionen Jahre alte fossile Fußspuren von Australopithecus afarensis entdeckt wurden,[21] die dessen bipede Fortbewegungsweise konserviert hatten. Umstritten blieb jedoch, ob Australopithecus afarensis – vergleichbar einem Schimpansen – mit ständig angebeugtem Kniegelenk und Hüftgelenk lief oder wie der anatomisch moderne Mensch energetisch günstiger mit durchgedrücktem Knie. Erst im Jahr 2010 erbrachte ein biomechanisches Experiment den Nachweis, dass die versteinerten Fußspuren ein Abdruckprofil konserviert haben, das weitgehend dem der heute lebenden Menschen gleicht: Beim aufrechten Gehen ist die Abdrucktiefe von Zehen und Ferse annähernd gleich; beim Schimpansen-artigen Gehen drücken sich die Zehen tiefer in den Boden als die Ferse.[22][23] Demnach hat sich ein – hinsichtlich der Bewegungsabläufe und der Energieeffizienz – menschenähnlicher aufrechter Gang bereits lange vor dem Entstehen der Gattung Homo entwickelt; gleichwohl sind individuelle ontogenetische Anpassungen des Fußes infolge häufigen Kletterns auch beim anatomisch modernen Menschen noch nachweisbar.[24][25] Vor rund zwei Millionen Jahren existierten in Südafrika zudem neben den aufrecht gehenden Arten nah verwandte Arten, deren Knochenbau in erster Linie eine Anpassung ans Klettern zeigt.[26]
Ältester fossiler Beleg für einen von seiner Funktion her dem Menschen vergleichbaren Fuß ist ein vollständig erhaltener, 3,2 Millionen Jahre alter Mittelfußknochen von Australopithecus afarensis aus Hadar (Sammlungsnummer AL 333-160), dessen Merkmale sowohl das Vorhandensein eines Längsgewölbes als auch eines Quergewölbes erkennen lassen.[27] Wie die gerade, nicht-gebogene Form des Knochens und noch erkennbare Ansatzstellen der Muskeln belegen, war seinerzeit der Übergang von einem für das Klettern im Geäst optimierten Greiffuß mit leicht gebogenem Mittelfußknochen zu einem als „Stoßdämpfer“ beim aufrechten Laufen fungierenden Fußgewölbe bereits weit fortgeschritten.
Einen weiteren direkten Beweis für eine Form der aufrechten, zweibeinigen Fortbewegungsweise, die im Wesentlichen mit der heute lebender Menschen vergleichbar ist, liefern ferner bei Laetoli freigelegte, 1,51 bis 1,53 Millionen Jahre alte und Homo erectus zugeschriebene Fußspuren.[28] Den Analysen zufolge waren die Zehen relativ kurz, der große Zeh war – anders als bei Affen und noch beim 4,4 Millionen Jahre alten Fossil Ardi – parallel zu den anderen Zehen ausgerichtet; die Füße waren wie bei den heute lebenden Menschen ein wenig nach oben gewölbt. Beim Laufen verlagerte sich das Gewicht von der Ferse zum Ballen. Aus den Abständen der Fußabdrücke sowie aus ihrer Größe und Tiefe schlossen die Forscher, dass die Erzeuger der Spuren eine ähnliche Körpergröße und ein ähnliches Gewicht wie die heutigen Menschen besaßen.
Ungeklärt ist hingegen bisher, ob die unter Primaten einzigartige Befähigung des Menschen zum Ausdauerlaufen – beispielsweise zum Bewältigen eines Marathonlaufs – eine bloße Begleiterscheinung der Befähigung zum aufrechten Gehen ist oder ob sie sich infolge eines gesonderten Selektionsdrucks entwickelte.[29][30]
Historisches
Schon Darwin hatte den aufrechten Gang des Menschen als „eines seiner auffallendsten Merkmale“ bezeichnet und über die Gründe seines Entstehens bei den „Urerzeuger[n] des Menschen“ zugleich spekuliert: „Sie würden dadurch besser im Stande gewesen sein, sich mit Steinen und Keulen zu vertheidigen oder ihre Beute anzugreifen oder auf andere Weise Nahrung zu erlangen.“[31] Die Befreiung der Hände von der Mithilfe beim Laufen und die damit verbundene Möglichkeit zum Werkzeuggebrauch wurde danach auch von anderen Forschern als der primäre Selektionsfaktor für das Entstehen der Bipedie angesehen.[32][33] Erst in jüngerer Zeit und nach der Entdeckung zusätzlicher homininer Fossilien wurde es zur Gewissheit, dass der aufrechte Gang mindestens 1,5 Millionen Jahre früher belegt ist als der Gebrauch von Werkzeugen. Zugleich ging aus paläoökologischen und paläoklimatologischen Befunden hervor, dass das Auftreten der anatomischen Merkmale für aufrechtes Gehen streng korreliert mit einem kälteren und trockeneren Klima und der Ausbreitung von offenen Savannen in Afrika.[34][35] Vermutet wird daher, dass die von Darwin als „Urerzeuger des Menschen“ bezeichneten Homininen neue Strategien entwickelten, um weiterhin Nahrung zu finden, weswegen sie auch größere Strecken am Boden zurücklegen mussten.[36][37]
Zum Entstehen des aufrechten Ganges gibt es zahlreiche weitere Hypothesen,[38] die einander nicht unbedingt ausschließen.

.jpg.webp)
Hypothese von der Entwicklung des aufrechten Gangs auf Bäumen
Nach Auffassung eines Forscherteams um Susannah Thorpe von der Universität Birmingham und Robin Crompton von der Universität Liverpool könnte sich der aufrechte Gang bereits bei den noch überwiegend auf Bäumen lebenden Vorfahren des Menschen entwickelt haben, um auf diese Weise zum Beispiel die Früchte am Ende dünner Zweige besser erreichen zu können. Die Forscher hatten ein Jahr lang Orang-Utans auf Sumatra beobachtet und 2007 darüber berichtet.[40] Diese Menschenaffen verbringen ihr ganzes Leben auf Bäumen und könnten daher als ein Modell dafür gelten, wie unsere Vorfahren vor mehreren Millionen Jahren gelebt haben. Die Analyse von rund 3000 Bewegungen ergab, dass die Orang-Utans sich auf sehr dünnen Zweigen auf zwei Beinen fortbewegen, sich dabei mit den Händen an darüber hängenden Zweigen festhalten und mit den Armen ihr Gewicht ausbalancieren. An mitteldicken Zweigen lassen sie sich dagegen eher hängen, sehr dicke Äste werden im Vierfüßler-Gang gemeistert. Dieser Argumentation zufolge wären die frühen Vorfahren das Menschen bereits in einer Epoche, als sie noch überwiegend auf Bäumen lebten, zumindest zeitweise auf zwei Beinen unterwegs gewesen. Erst später, als viele afrikanische Regenwälder während einer Trockenperiode nach und nach verschwanden, hätten sie mit dem „Umzug“ auf den Boden reagiert, wo sie den aufrechten Gang weiter entwickelten und schließlich perfektionierten. Die andere evolutive Linie, die zu den heutigen Schimpansen und Gorillas führte, habe hingegen einen Vierfüßer-Gang auf den Handknöcheln (den sogenannten Knöchelgang) entwickelt, um in den ausgedünnten Wäldern rasch von einem Baum zum nächsten gelangen zu können.
Unterstützt wird diese Hypothese durch die Tatsache, dass einige Homininifunde aus Gegenden stammen, die zu ihren Lebzeiten eindeutig bewaldet waren. Dies gilt zum Beispiel für den im Jahr 2000 entdeckten Orrorin und für Australopithecus-Funde wie „Lucy“. Gestützt wird diese Hypothese ferner durch genaue Analysen des 4,4 Millionen Jahre alten Skeletts Ardi von Ardipithecus ramidus.[41] Friedemann Schrenk beschrieb dessen Fortbewegungsweise so: „Spannend ist die Konstruktion von Ardis Fuß. Er war so gebaut, dass sie grazil auf den Zweigen spazieren konnte. Sie hangelte sich also nicht an ihnen entlang, wie das Schimpansen tun.“[42] Ein Vergleich der Handgelenk-Knochen von Schimpansen und Gorillas ergab zudem, dass deren Knöchelgang sich unabhängig voneinander entwickelte, dass deren letzter gemeinsamer Vorfahre also noch nicht diese Laufhaltung aufwies. Hieraus wurde abgeleitet, dass die Hominini ebenfalls nicht von Vorfahren mit Knöchelgang abstammen.[43] Auch der 2019 publizierte Fund von Danuvius guggenmosi wurde als Bestätigung dieser Hypothese interpretiert.[44]
Auch Beobachtungen an frei lebenden Schimpansen in Tansania wurden 2022 dahingehend interpretiert, dass sich die Fähigkeit zur zweibeinigen Fortbewegung bereits bei Baumbewohnern herausgebildet habe.[45]
Hypothese vom Zusammenhang von aufrechtem Gang und Nahrungsaufnahme
Eine Hypothese zum Entstehen des aufrechten Ganges infolge der Nahrungsaufnahme in einer bestimmten Haltung („postural feeding hypothesis“) wurde vom Paläoanthropologen Kevin D. Hunt von der Indiana University ins Gespräch gebracht.[46] Diese Theorie macht geltend, dass Schimpansen bei der Nahrungsaufnahme regelmäßig zweibeinig seien. Auf dem Boden würden sie nach oben greifen, um an Früchte zu gelangen, die von kleineren Bäumen hingen, und auf den Bäumen würde die Fähigkeit zur zeitweiligen Bipedie beim Greifen nach einem über ihnen befindlichen Ast genutzt. Diese zweibeinigen Bewegungen entwickelten sich der Theorie zufolge zu häufigeren Gewohnheiten.
Hunts Hypothese kann zwar als Vorläufer zur Hypothese von der Entwicklung des aufrechten Gangs auf Bäumen beschrieben werden, sie wurde jedoch 2009 durch die Analysen des Körperbaus von Ardipithecus ramidus „falsifiziert“, wie C. Owen Lovejoy ausdrücklich anmerkte.[47]
Savannen-Hypothese
Als Savannen-Hypothese wurde die Annahme bezeichnet, die Evolution der Bipedie sei bei den Menschenaffen vor rund 7 bis 8 Millionen Jahren dadurch in Gang gekommen, dass die damals noch in Wäldern lebenden Arten ihren Lebensraum in offene, baumlose Savannen verlegt und dort zum aufrechten Gehen gefunden hätten; schon Jean-Baptiste de Lamarck (1744–1829) hatte dies vermutet. Diese Hypothese gilt heute aufgrund zahlreicher Fossilfunde als widerlegt, da die frühesten aufrecht gehenden und daher zu den Hominini gestellten Gattungen wie Sahelanthropus und Orrorin keine reinen Savannen-Bewohner waren, sondern in Galeriewäldern lebten. Auch Ardipithecus ramidus lebte in einer Umwelt, die „Habitate aus geschlossenem Waldland und aufgelockertem Baumbestand umfasste.“[48]
Als unerheblich[49] für das Entstehen des aufrechten Gangs gilt daher heute auch das thermoregulatorische Modell, das der Zoologe und Evolutionsbiologe Peter Wheeler von der Liverpool John Moores University ab 1983 ins Gespräch gebracht hatte.[50] Er hatte unter anderem argumentiert, die Bipedie habe sich entwickelt, weil diese Körperhaltung das Gehirn beim Aufenthalt in der offenen Savanne vor Überhitzung geschützt habe: Je höher der Körper eines Menschenaffen sich über den Boden erhoben habe, desto eher sei er höheren, kühlenden Windgeschwindigkeiten ausgesetzt gewesen.
Gleichwohl gehen Forscher davon aus, dass der aufrechte Gang im vor 4 Millionen Jahren nachgewiesenermaßen heißen afrikanischen Lebensraum der Hominini auch aus klimatischen Gründen vermutlich vorteilhaft war[51] und dass die von Wheeler in den 1980er- und 1990er-Jahren herausgestellten thermoregulatorischen Aspekte zum weitgehenden Verlust der Körperbehaarung beitrugen.[52]
Verhaltenshypothese
Der Anatom C. Owen Lovejoy leitete 1981 die Bipedie aus dem Sozialverhalten der frühen männlichen Menschenaffen ab.[53] Seine Hypothese besagte, dass die Bipedie infolge einer monogamen Lebensweise entstanden sei: Die Männchen jener Menschenaffen-Arten, die sich zu den frühen Hominini fortentwickelten, seien monogam geworden und hätten tagsüber ihre Familien alleingelassen, um nach Nahrung zu suchen. Diese Nahrung hätten sie zu ihrer Familie tragen müssen, und die effektivste Fortbewegungsweise sei in dieser Situation das zweibeinige Laufen gewesen. Lovejoys Hypothese, die mangels fossiler Überlieferung nicht unmittelbar durch paläoanthropologische Befunde zu belegen ist, rief umgehend massive Kritik hervor.[54] Insbesondere wurde darauf verwiesen, dass monogame Primaten in der Regel keinen Sexualdimorphismus aufweisen; männliche Exemplare von Australopithecus afarensis besaßen jedoch fast das doppelte Gewicht von Weibchen – dies sei ein Merkmal, das man bei polygamen Arten erwarten würde. Ferner seien monogame Primaten stark territorial, lebten also nicht in größeren sozialen Verbänden; fossile Hinweise zeigten jedoch, dass Australopithecus afarensis in Gruppen lebte.
2009 widerrief C. Owen Lovejoy seine Hypothese unter Verweis auf die Funde von Ardipithecus ramidus in Hadar (Äthiopien): „Seit der Zeit Darwins standen zumeist die heute lebenden afrikanischen Menschenaffen Pate, wenn die frühe Evolution des Menschen rekonstruiert wurde. Diese Modelle veranschaulichen grundlegende menschliche Verhaltensweisen als Steigerung von Verhaltensweisen, die man bei Schimpansen und/oder Gorillas beobachten kann (zum Beispiel aufrechte Haltung bei der Nahrungsaufnahme, männliches Dominanzverhalten, Werkzeuggebrauch, Kultur, Jagd und Kriegsführung). Ardipithecus falsifiziert im Wesentlichen solche Modelle, denn die heute lebenden afrikanischen Menschenaffen sind hochgradig abgeleitete Verwandte unseres letzten gemeinsamen Vorfahren.“[47]

Wat-Hypothese
Der sogenannten Wat-Hypothese (auch: „Uferhypothese“) zufolge entwickelte sich die Bipedie der Hominini als ein Ergebnis des zweibeinigen Watens bei der Nahrungssuche – zum Beispiel nach Muscheln[55] – in Gewässern mit niedrigem Wasserstand; zweibeiniges Waten wird gelegentlich bei den Bonobos, den Flachlandgorillas und den Nasenaffen beobachtet. Zweibeiniges Waten bietet den Vorteil, den Kopf zum Atmen über Wasser zu halten. In mehreren Publikationen versuchte der Evolutionsbiologe Carsten Niemitz nachzuweisen, dass keines der anderen Erklärungsmodelle das Entstehen des aufrechten Ganges plausibel erklären könne.[56][57] Teile dieser Theorie finden sich auch in der Wasseraffen-Theorie.[58]
Wirbelsäule und Beckengürtel

Die Entwicklung der Fähigkeit zum dauerhaft aufrechten Gehen setzte eine Vielzahl von Anpassungen des Skeletts voraus, insbesondere im Bereich der Wirbelsäule, des Beckengürtels und der Hüftgelenke, der Kniegelenke, der Füße sowie des Foramen magnum (des großen Hinterhauptlochs an der Schädelbasis, wo Rückenmark und Gehirn ineinander übergehen).[59] Veränderungen betrafen sowohl den Bau der Knochen als auch der Skelettmuskeln sowie deren Ursprung und Ansatz.
Eine dauerhaft zweibeinige Fortbewegungsweise und das aufrechte Stehen erfordern gleichermaßen, dass der Schwerpunkt des Körpers sich exakt senkrecht oberhalb der Auftrittsfläche der Füße befindet. Deshalb verlagerte sich das Foramen magnum während der Entstehung des aufrechten Gangs nach vorn und befindet sich heute (wie Becken, Knie und Füße) im Bereich des Körperschwerpunkts. Wenn vierfüßige Tiere sich auf den Hinterbeinen aufrichten, erfüllen sie diese Voraussetzung nur, wenn ihre Hinterbeine in Hüft- und Kniegelenken gebeugt sind, da sie andernfalls – bei gestreckten, vertikal ausgerichteten Beinen – nach vorn überkippen würden. Im Verlauf der Evolution der Vorfahren des anatomisch modernen Menschen wurde daher der Körperschwerpunkt zum Rücken hin verlagert. Hierzu trug insbesondere die Ausbildung der nach vorn gerichteten Wirbelsäulen-Krümmung (Lordose) im Bereich der Halswirbelsäule und der Lendenwirbelsäule bei, weswegen letztere bei Schwangeren wegen der Schwerpunktverlagerung während einer Schwangerschaft besonders stark ausgeprägt ist.[60] In Höhe des Brustkorbs sowie im Bereich des Kreuzbeins weicht die Wirbelsäule hingegen gekrümmt nach hinten aus (Kyphose) und gibt den inneren Organen Raum, so dass sich der typische Eindruck einer doppelt S-förmigen Krümmung ergibt (bei überwiegend vierfüßigen Affen ist sie c-förmig). Zugleich übernahmen die Beckenknochen die zusätzliche Aufgabe, die inneren Organe zu stützen.[61]
Eine Besonderheit ist zudem der im Vergleich mit allen anderen Menschenartigen sehr enge Beckenkanal, durch den der – im Vergleich mit anderen Menschenartigen ebenfalls bereits vorgeburtlich sehr große – Schädel des Fetus bei der Geburt hindurch gelangen muss – und dies, obwohl das weibliche Becken viel weiter ist als das männliche Becken.[62] Die Innenmaße des weiblichen Beckens sind nahezu identisch mit der Kopfgröße des Neugeborenen, was dazu führt, dass „Mutter und Neugeborenes ein beträchtliches Risiko für eine traumatische Geburt“ tragen.[63][64][65]
Die wiederholt von Forschern vertretene Hypothese, Beckengürtel und Beckenkanal seien relativ schmal geblieben, weil ein breiterer Beckengürtel einen größeren Beinabstand zur Folge gehabt hätte und dies unvorteilhaft für eine rasche Fortbewegung gewesen sei, ist umstritten.[66]


Hände
Im Vergleich mit anderen Affen haben die Hände des anatomisch modernen Menschen eine kürzere Handfläche, kürzere Finger sowie längere, kräftigere und beweglichere Daumen. Insbesondere der opponierbare Daumen vereinfacht das Zugreifen und erleichtert beispielsweise das geschickte Handhaben von Werkzeugen. Verantwortlich dafür, dass der Daumen – anders als bei anderen Affen – mit seiner Kuppe die Kuppen der anderen Finger berühren kann, ist ein speziell geformtes Daumengrundgelenk. Dies ermöglicht den Menschen zudem ihre Hände zu Fäusten zu ballen, was wiederum dazu führt, dass die Hand zu einem effektiven Schlagwerkzeug wurde (beim Boxen), ohne die Finger einem allzu hohen Verletzungsrisiko auszusetzen.[67] Bereits die Ausrichtung der feinen Knochenbälkchen (Trabekeln) in den Mittelhandknochen von Australopithecus africanus weist – vor zwei bis drei Millionen Jahren – Merkmale auf, die als Hinweis auf eine Opponierbarkeit des Daumens interpretiert wurden,[68] aber vermutlich erst seit rund zwei Millionen Jahren – von Homo erectus – kann diese Bewegung kraftvoll ausgeführt werden.[69]
Mit Hilfe von 39 Testpersonen wurde zudem experimentell nachvollzogen, welchen Einfluss das Herstellen von Steingerät – die hierzu nötigen Bewegungen – und das Benutzen von Steingerät auf die Evolution der Hand hatte. Demnach waren die Kräfte beim Nüsseknacken nicht groß genug um die Anatomie der Hand maßgeblich zu verändern, wohl aber das Zurichten von Abschlägen bei der Herstellung von Steinartefakten und das kräftige Zuschlagen beim Öffnen von Röhrenknochen, um an deren Knochenmark zu gelangen.[70]
Schädel- und Gehirnentwicklung
Neben den Walen – speziell den Delfinen – gelten die Primaten als die Säugetiere mit den am komplexesten entwickelten Gehirnen. Das Wachstum des Gehirns ist bereits beim menschlichen Fötus (also schon im Mutterleib) größer als beim Fötus der Schimpansen.[71] Eine vergleichende Genomanalyse ergab, dass die Expression von Genen und die Proteinbiosynthese „bei Mensch und Schimpanse sich insbesondere im Gehirn dramatisch unterscheiden“, während die Expressionsmuster in Leber und Blut kaum voneinander abweichen.[72]
Bereits vor rund 300.000 Jahren besaß das Gehirn des frühen archaischen Homo sapiens das gleiche Volumen wie das heutiger Menschen; deren rundliche Schädelform entwickelte sich hingegen deutlich später: Erst Fossilien, die jünger als 35.000 Jahre alt sind, besitzen die gleiche runde Form wie die heutigen Menschen.[73]
Vergrößerung des Volumens
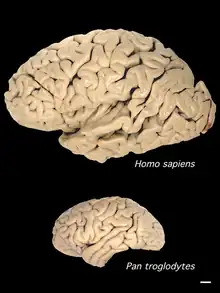
(rechts unten als Maßstab: 1 cm)
Im Verlauf der Zerebralisation bestand bei den Hominini vor allem eine Tendenz zur Volumen- und Oberflächenzunahme des Gehirns, speziell im Bereich der Großhirnrinde, was unter anderem erhebliche Auswirkungen auf die Nahrungsaufnahme hatte: Das Gehirn des anatomisch modernen Menschen macht zwar nur etwa zwei Prozent vom Körpergewicht aus, es verbraucht aber rund 20 Prozent der Stoffwechselenergie;[74] im Ruhezustand entspricht der Grundumsatz eines Erwachsenen einer Leistung von ungefähr 100 Watt, wovon sogar 30 bis 60 Prozent auf das Gehirn entfallen.[75] Mit der Vergrößerung des Gehirnvolumens ging eine Steigerung der Blutversorgung für das Gehirn einher.[76]
Die Gründe für die Vergrößerung des Schädelvolumens und für die vielfältigen Wechselwirkungen zwischen Gehirnentwicklung, anatomischen Veränderungen des Gesichtsschädels und anderen Körpermerkmalen sowie beispielsweise dem Nahrungserwerb sind jedoch noch immer relativ wenig erforscht.[77] Die Vergrößerung des Gehirns der Hominini in der Epoche der Australopithecinen vor rund 3 bis 2 Millionen Jahren sowie bei Homo erectus korrelierte jedoch mit einer Abkühlung des Klimas in Afrika; zwei in den Jahren 2000 und 2009 vorgelegte Berechnungen lieferten Hinweise darauf, dass in kühlerem Klima die Wärmeabstrahlung des in der geschlossenen Schädelkapsel einsitzenden Gehirns leichter vonstattenging als zuvor und daher eine „Wachstumsbremse“ entfiel, so dass sich ein größeres und deshalb mehr Wärme produzierendes Gehirn entwickeln konnte.[75][78] Möglicherweise genügte hierfür bereits eine Verringerung der mittleren Temperatur um 1,5 Grad Celsius.[79] Eine andere Hypothese nimmt an, dass die Gehirnvergrößerung mit der Populationsgröße korreliert und die nötige soziale Durchsetzungsfähigkeit gegenüber konkurrierenden Individuen oder Gruppen von Artgenossen in einer größer werdenden Population eine treibende Kraft der Gehirnentwicklung war.[80]
| Taxon | Gehirnvolumen in cm3 |
|---|---|
| Schimpansen | ca. 400[81] |
| Gorilla-Mann | 535[82] |
| Sahelanthropus tchadensis | 365[83] |
| Ardipithecus ramidus | 280–350[84] |
| Australopithecus afarensis | 458 (335–580)[83] |
| Australopithecus africanus | 464 (426–502)[83] |
| Homo rudolfensis | ca. 750[85] (501–950)[83] |
| Homo habilis | 610[86] (544–674)[83] |
| Homo ergaster | 764 (640–888)[83] |
| Homo erectus | 1003 (956–1051)[83] |
| Homo antecessor | ca. 1000[83] |
| Homo heidelbergensis | 1204 (1130–1278)[83] |
| Neandertaler | 1426 (1351–1501)[83] |
| Homo floresiensis | 380[87] |
| Homo sapiens | 1478 (1444–1512)[83] |
Das Volumen des Gehirns der fossilen Hominini konnte anhand von Schädelfragmenten zumindest näherungsweise rekonstruiert werden. Die nebenstehende Tabelle gibt hierzu einen Überblick. Da Hirn etwa die Dichte von Wasser hat, entspricht das Volumen ungefähr der Masse in Gramm. Die Angaben zu fossilen Arten sind Schätzungen auf Grundlage von meist unvollständigen und deformierten Funden; unterschiedliche Fachbücher können daher voneinander abweichende Angaben enthalten.
Im Vergleich mit den diversen Arten der Australopithecinen – insbesondere zum Beispiel mit Paranthropus aethiopicus – besitzen alle bisher bekannten Arten der Gattung Homo einen extrem schwachen Kauapparat mit zurückgebildeter Kaumuskulatur. US-Forschern um Hansell H. Stedman zufolge besteht ein zeitlicher und funktioneller Zusammenhang zwischen dieser Rückbildung und dem Beginn der Vergrößerung des Gehirns. Vor rund 2,4 Millionen Jahren habe sich die Mutation eines Gens ereignet, das für das Protein MYH16 (myosin heavy chain 16) kodiert; das MYH16-Gen ist bei Säugetieren ausschließlich im Bereich der Kiefer aktiv – im Musculus temporalis und im Musculus masseter – und bewirkt die Produktion von besonders belastbaren Myosin-Ketten in den Muskelzellen (siehe Heavy Chain). Die Mutation habe dazu geführt, dass dieses Gen seitdem in der Abstammungslinie inaktiv ist, die zu den heute lebenden Menschen führt.[88] Es sei kein Zufall, dass aus der gleichen erdgeschichtlichen Epoche die frühesten Fossilien der Gattung Homo stammen: Der Ausfall des Gens habe eine markante Verkleinerung der einzelnen Muskelfasern und – als Folge davon – der gesamten Kaumuskulatur zur Folge gehabt. Der damit verbundene Wegfall der erheblichen Zugkraft von Muskeln, die am Schädel ansetzen und den Unterkiefer bewegen, sei wiederum eine Voraussetzung dafür gewesen, dass sich das Gehirn und mit ihm der gesamte Schädel später vergrößern konnten. Schimpansen und andere Primaten verfügen auch heute noch über das intakte, nicht mutierte Gen.
Mit Hilfe computertomographischer Analysen von fossilen und modernen Schädeln konnten Abdrücke rekonstruiert werden, die von den Gehirnwindungen und -furchen auf den Innenflächen der Schädel hinterlassen wurden. Den Befunden zufolge haben sich die modernen menschlichen Gehirnstrukturen erst vor 1,5 bis 1,7 Millionen Jahren herausgebildet. Ältere Schädel weisen noch die ursprünglichen, menschenaffen-ähnlichen Gehirnwindungen auf.[89]
Das Gehirnvolumen des anatomisch modernen Menschen weist eine erhebliche Spannweite auf, die eine unmittelbare Folge der gleichfalls erheblichen Variabilität seiner Körpergröße ist. Da Frauen im Mittel kleiner sind als Männer, haben Frauen im Mittel auch ein etwas kleineres Gehirn als Männer[74] (siehe dazu: Gehirne von Männern und Frauen).
Bemerkenswert ist ferner, dass das Gehirn der heute lebenden Menschen ungefähr drei bis vier Prozent kleiner ist als das Gehirn der Vorfahren vor 10.000 bis 15.000 Jahren. Denkbar ist, dass dies eine Folge der Erwärmung nach dem Ende der letzten großflächigen Vereisung ist; es wurde aber auch argumentiert, dass möglicherweise die Konnektivität optimiert wurde oder dass eine optimierte Sozialstruktur die Überlebenschancen des Einzelnen verbesserte und dies auf die Gehirngröße zurückwirkte.[90]
Spezielle Anpassungen
Es gibt bislang nur wenige gesicherte Erkenntnisse darüber, welche Regionen des Gehirns in welcher Epoche einem bestimmten Selektionsdruck unterlagen und sich daher veränderten. Im erhaltenen Schädelausguss des so genannten Kindes von Taung (eines drei- bis vierjährigen Australopithecus africanus) blieb jedoch auch eine „Knochennaht“ (metopische Sutur) zwischen beiden Hälften des Stirnschädels erhalten, die – wie meist auch bei gleich alten Kindern von Homo sapiens – noch nicht verknöchert war; bei Schimpansen-Jungen im Alter des Taung-Kindes ist diese Naht hingegen bereits verknöchert. Daraus wurde unter anderem geschlossen, dass schon bei Australopithecus africanus die postnatale Zunahme des Gehirnvolumens – ähnlich wie bei Homo – ausgeprägter war als bei den Schimpansen.[91]
Dreidimensionale Rekonstruktionen ergaben beispielsweise, dass die Riechkolben des anatomisch modernen Menschen ungefähr 12 Prozent mehr Volumen beanspruchen als die des Neandertalers und dass bei Homo sapiens auch der Temporallappen größer ist als er beim Neandertaler war.[92] Das Gleiche trifft zu auf den oberen Parietallappen, dessen Volumenvergrößerung zugleich als Ursache gilt für das rundlichere Scheitelbein bei Homo sapiens.[93]
In der Online-Zeitschrift Royal Society Open Science wurde im Jahr 2017 berichtet, dass sich der Blutfluss zum Gehirn – außer bei Homo heidelbergensis und bei den allerdings fossil bislang schlecht belegten Fossilien von Homo rudolfensis und den Dmanissi-Funden – in Relation zur Vergrößerung des Gehirns der jeweiligen Arten überproportional stark vergrößerte.[76]
Während das Gehirnvolumen der Schimpansen im Alter unverändert bleibt, schrumpft es bei alternden Menschen merklich. Dies ist vermutlich eine Folge der bei Menschen im Vergleich mit Schimpansen deutlich erhöhten Lebenserwartung (ca. 80 bis 90 Jahre bei Menschen, ca. 50 Jahre bei Schimpansen) und somit ein evolutiv relativ junges Phänomen.[94]
Der Verlust markanter Überaugenwulste und diverse andere evolutive Veränderungen an den insgesamt 14 Knochen des Gesichts – und daraus resultierenden Veränderungen der Muskelansätze – wurden 2019 in einem Review-Artikel in Zusammenhang gebracht mit einer erst hierdurch möglichen, umfassenderen nonverbalen Kommunikation durch minimale Muskelbewegungen, die Hinweise auf subtile Emotionen geben und so zur sozialen Interaktion in Gruppen beitragen können.[95]
Zähne und Gebiss

Zähne sind hochgradig widerstandsfähig gegen zerstörerische Umwelteinflüsse, deshalb sind sie die am häufigsten gefundenen Fossilien von Primaten. Ihre Größe und Form, die Dicke ihres Zahnschmelzes und das Verhältnis der beiden stabilen Kohlenstoff-Isotope 12C und 13C im Zahnschmelz (vergl. Isotopenuntersuchung) können Auskunft geben über die stammesgeschichtliche Zugehörigkeit ihrer ehemaligen Besitzer, über ihr Sozialverhalten und ihre Nahrung. Allerdings sind gerade diese Gewebe sowie die ebenfalls widerstandsfähigen Kiefer „besonders anfällig für Homoplasien“[96] (für parallele, unabhängige Entstehung) als Folge ähnlicher Ernährungsweisen, was ihren Nutzen für taxonomische Fragestellungen begrenzen kann.
Der schon bei Homo erectus nachweisbare evolutive Trend zur Verkleinerung der Zähne wurde als eine Folge des Gebrauchs von Steinwerkzeugen interpretiert, mit deren Hilfe die Nahrung zerkleinert wurde, was wiederum die Kaulast von Zähnen, Oberkiefer und Unterkiefer reduzierte.[97]
Verkleinerung der Eckzähne
Der Mensch und die anderen Menschenaffen gehören zu den Altweltaffen. Deren früheste bekannte Vertreter – wie beispielsweise Aegyptopithecus – trugen zwei große, längliche Eckzähne im Oberkiefer, die durch stetiges Reiben an jeweils einem Vorderbackenzahn des Unterkiefers (durch Honen) geschärft wurden. Zugleich wies der Oberkiefer zwei Zahnlücken (Diastema) zwischen Eck- und Schneidezähnen auf, in die jeweils einer der Eckzähne des Unterkiefers passte. Im Verlauf der Hominisation wurden die Eckzähne kleiner und die Zahnlücke im Oberkiefer verschwand.
Schon 1871 hatte Charles Darwin die heute noch in Afrika lebenden Schimpansen und Gorillas als die nächsten Verwandten der Menschen erkannt und daher vermutet, dass sich auch der anatomisch moderne Mensch in Afrika entwickelt habe.[98] Zugleich hatte Darwin aber auch den Körperbau dieser Menschenaffen im Sinne eines ursprünglichen Merkmals gedeutet. Seiner Vermutung nach
- „waren die früheren männlichen Vorfahren des Menschen wahrscheinlich mit grossen Eckzähnen versehen; in dem Maasse aber, als sie allmählich die Fertigkeit erlangten, Steine, Keulen oder andere Waffen im Kampfe mit ihren Feinden zu gebrauchen, werden sie auch ihre Kinnladen und Zähne immer weniger und weniger gebraucht haben. In diesem Falle werden die Kinnladen in Verbindung mit den Zähnen an Grösse reducirt worden sein, wie wir nach zahllosen analogen Fällen wohl ganz sicher annehmen können.“[99]
Darwins Vermutung beeinflusste mehr als 100 Jahre lang zahllose Versuche, die ursprüngliche Bezahnung der Hominini – abgeleitet von der Bezahnung der Schimpansen – zu rekonstruieren. Durch Fossilfunde belegbare Hypothesen zum Gebiss der frühen Hominini waren jedoch erstmals möglich, nachdem man das 4,4 Millionen Jahre alte Fossil Ardi und zahlreiche Zähne von anderen Individuen der Art Ardipithecus ramidus entdeckt hatte.[100] Weder hatte Ardi eine besonders stark ausgeprägte Schnauze, noch hatten ihre männlichen Artgenossen die von Schimpansen bekannten, dolchartig verlängerten und von außen deutlich wahrnehmbaren Eckzähne („Fangzähne“). Sollte Ardipithecus ramidus zu Recht in die Entwicklungslinie der Hominini gestellt worden sein, würden seine anatomischen Merkmale belegen, dass der evolutionäre Trend hin zu verkleinerten Eckzähnen bereits vor mehr als vier Millionen Jahren eingesetzt hatte, also lange vor der Herstellung erster Steinwerkzeuge, und somit das gesamte Pliozän hinweg angedauerte.
Die dolchartigen Eckzähne des Oberkiefers dienen bei den heute lebenden männlichen Affen regelmäßig auch als Waffe bei Rangordnungskämpfen innerhalb der eigenen Gruppe und bei Kämpfen mit Individuen anderer Gruppen. Die früh einsetzende Verkleinerung der Eckzähne legt daher nahe, dass sich aufgrund sexueller Selektion auch das agonistische Verhalten und das Imponierverhalten verändert hat, „lange bevor die Hominini ein vergrößertes Gehirn hatten und Steinwerkzeuge benutzten.“[101]
Veränderungen der Zahnzahl und der Schnauze

Ein zweiter, langfristiger evolutionärer Trend, der mit der Verkleinerung der Zähne und der Schnauze einherging, kann aufgrund der Verringerung der Zahnzahl rekonstruiert werden. Weitgehend anerkannt ist heute, dass die ursprünglichen höheren Säugetiere in jeder Kieferhälfte drei Schneidezähne, einen Eckzahn, vier Vorderbackenzähne und drei hintere Backenzähne hatten. Ihre Zahnformel lautet demnach 3 • 1 • 4 • 3, ihre Zahnzahl betrug 44.[102] Alle heute lebenden Altweltaffen haben hingegen die Zahnformel 2 • 1 • 2 • 3 und somit 32 Zähne. Bei den Menschen ist der Trend zur Verringerung insofern unmittelbar zu beobachten, als der dritte (hintere), so genannte Weisheitszahn erhebliche Unterschiede der Form sowie des Durchbruchzeitpunkts aufweist und seine Zahnanlagen gelegentlich völlig fehlen; er kann daher als Rudiment bezeichnet werden.
Ebenfalls verringert hat sich im Verlauf der Hominisation die Anzahl der Zahnwurzeln, mit denen die Vorderbackenzähne im Kiefer verankert sind: Die frühen Arten der Hominini aus der Gruppe der Australopithecinen hatten zwei Wurzeln pro Vorderbackenzahn, Homo sapiens besitzt nur eine Wurzel.[103] Im Vergleich zu den Schimpansen ist bei den Menschen zudem während der Individualentwicklung der Wechsel vom Milchgebiss zum Dauergebiss verzögert, was zugleich als Indiz für eine Verlängerung der Jugendphase beim Menschen gilt. Bei den nicht-menschlichen Menschenaffen beginnt der Durchbruch der Dauerzähne im Alter von 3,0 bis 3,5 Jahren,[102] beim Menschen hingegen meist erst im 6. Lebensjahr; Ursache ist eine verzögerte Bildung der Zahnwurzeln.[104][105] Ein weiteres Merkmal des jungen Homo sapiens ist, dass der Molar M1 und der Schneidezahn I1 des Dauergebisses gemeinsam durchbrechen, gefolgt vom Schneidezahn I2, während beim jungen Schimpansen zunächst nur der Molar M1 durchbricht, gefolgt von beiden Schneidezähnen.[106][107]
Die schon von Charles Darwin auf veränderte Gewohnheiten bei der Nahrungsaufnahme zurückgeführte Verkürzung des Unterkiefers wurde 2011 durch eine Studie an elf heute lebenden Populationen bestätigt. Ihr zufolge haben Jäger und Sammler längere und schmalere Unterkiefer als Sesshafte, die sich von Feldfrüchten, Milcherzeugnissen oder Zuchttieren ernähren.[108]
Behaarung

Auffallend beim heute lebenden Menschen ist, dass er – als einziger aller heute lebenden Primaten – neben dem meist unauffälligen Vellushaar allenfalls eine außerordentlich geringe Körperbehaarung besitzt. Da bisher keine paläoanthropologisch relevanten Haarfunde entdeckt wurden, sind weder Aussagen zur Behaarung ausgestorbener Spezies der Hominini möglich, noch lässt sich die Zeitspanne paläoanthropologisch belegen, während der bei seinen Vorfahren das Fell verloren ging. Das über einige Jahre ungebremste Wachstum des Haupthaares findet ebenfalls keine Parallele unter den Primaten; eine klare Funktion ist nicht ersichtlich.
Hypothesen zum Zeitpunkt
Aus molekularbiologischen Analysen zur Evolution der Familie der Menschenläuse (Pediculidae) und zur Entstehungszeit von dunkler Hautfarbe wurden einige Anhaltspunkte dafür abgeleitet, wann sich die Reduzierung der Körperbehaarung ungefähr zugetragen hat.
Die Familie der Menschenläuse besteht aus den Gattungen Pediculus und Phtirus. Zu Pediculus zählt die an den Menschen angepasste Kleiderlaus (Pediculus humanus humanus, in Abgrenzung von der Kopflaus Pediculus humanus capitis auch benannt als „Körperlaus“ Pediculus humanus corporis[109]) sowie die an Schimpansen angepasste Art Pediculus schaeffi. Phtirus kommt beim Menschen als Filzlaus (Phtirus pubis), beim Gorilla als Phtirus gorillae vor. Aus Genanalysen wurde abgeleitet, dass der letzte gemeinsame Vorfahr von Pediculus humanus spec. und Pediculus schaeffi vor rund 6 Millionen Jahren existierte und der letzte gemeinsame Vorfahre von Phtirus pubis und Phtirus gorillae vor etwa 3 bis 4 Millionen Jahren;[110] ferner, dass die Trennung von Pediculus humanus humanus und Pediculus humanus capitis vor 72.000 ± 42.000 Jahren erfolgte.[111] Daraus lässt sich näherungsweise folgender Zeitablauf rekonstruieren: Seit 5 bis 6 Millionen Jahren leben die Vorfahren der Schimpansen und der Menschen und mit ihnen die Vorfahren der Parasiten Pediculus schaeffi und Pediculus humanus spec. getrennt voneinander. Vor rund 3 Millionen Jahren konnte sich der gemeinsame Phtirus-Vorfahre, vom Gorilla stammend, dauerhaft bei den damals lebenden Vorfahren der heutigen Menschen ansiedeln, bei gleichzeitiger Anwesenheit von Pediculus humanus spec. Demnach bestanden vermutlich bereits in dieser Epoche bei den Vorfahren des Menschen unterschiedliche Haar-Biotope, etwa auf dem Kopf und im Schambereich, die durch Haar-arme Zonen getrennt waren (was ungefähr unserem heutigen Haarbewuchs entspräche). Vor etwa 60.000 bis 80.000 Jahren schließlich kann die Aufspaltung von Pediculus humanus spec. in die beiden Unterarten Pediculus humanus capitis und Pediculus humanus humanus als Anzeichen für die Verwendung von Kleidung gedeutet werden. Eine zweite, davon unabhängige Studie bestätigte im Grundsatz diese Argumentation, kam aber zu höheren Werten: Ihr zufolge ereignete sich die letztgenannte Aufspaltung spätestens vor 83.000 Jahren, möglicherweise aber auch schon vor 170.000 Jahren.[112]
Hinweise auf den ungefähren Zeitpunkt erbrachten auch Berechnungen zur Entstehenszeit von dunkler Hautfarbe. Viele Forscher vermuten, dass die behaarten frühen Arten der Hominini – wie die Schimpansen – eine rosafarbene Haut besaßen. Eine bestimmte Variante des Gens MC1R, das an der Hautpigmentierung beteiligt ist, kommt bei allen dunkelhäutigen Afrikanern vor und existiert laut einer Studie von Forschern der University of Utah seit 1,2 Millionen Jahren. Daraus wurde wiederum abgeleitet, dass die Körperbehaarung damals schon recht dünn gewesen sein muss.[113]
Hypothesen zu Ursachen und Folgen
Über die Frage, warum die Reduktion des Fells eingesetzt hat, gehen die Ansichten der Evolutionsbiologen auseinander. „Die vielleicht plausibelste Theorie geht davon aus, dass die Nacktheit zusammen mit der Vermehrung der Schweißdrüsen ursprünglich zur Regulierung der Körpertemperatur diente. Das Merkmal wäre also bereits vor rund zwei Millionen Jahren bei frühen Menschen (H. erectus) als Anpassung an ausdauerndes Laufen unter Hitzebelastung entstanden.“[114] Hierfür spricht, dass Menschen sehr viel mehr ekkrine Schweißdrüsen besitzen als ihre behaarten Verwandten und daher – mangels Fell – der von ihnen produzierte dünnflüssige Schweiß direkt auf der Haut verdunsten kann („Verdunstungskälte“).[115] Gestützt wird diese Hypothese unter anderem durch eine Modellrechnung, der zufolge nur ein weitgehend unbehaartes, zu starkem Schwitzen befähigtes Individuum der Gattung Homo tagsüber in heißem, offenem Gelände habe aktiv sein können.[49] Dies gilt als evolutionärer Vorteil, der die Ausdauerjagd ermöglichte und möglicherweise zugleich die Anfälligkeit für Ektoparasiten reduzierte.[116] Als vorteilhaft für die Ausdauerjagd und für das mit ihr verbundene, zeitweise Verlassen der Nähe zu Trinkwasserquellen, erwiesen sich laut einer 2021 veröffentlichten Studie ferner Veränderungen im Wasserhaushalt: Der anatomisch moderne Mensch muss – trotz erhöhter Schweißproduktion – zwischen 30 und 50 Prozent weniger Flüssigkeit aufnehmen als ein Schimpanse, um seinen Wasserhaushalt langfristig stabil zu halten.[117]
Die behaarte Kopfhaut wiederum reduziert Experimenten zufolge den Wärmegewinn durch Sonneneinstrahlung, wobei dicht gelocktes Haar Kopfhaut und Gehirn am effektivsten vor Sonneneinstrahlung schützt und gleichzeitig den Bedarf an Schweiß zum Ausgleich des Wärmegewinns minimiert.[118]
Eine Mutation des Gens EDAR führte vermutlich vor rund 30.000 Jahren bei den Bewohnern Ostasiens dazu, dass die Dichte ihrer Schweißdrüsen noch größer und zugleich die Haare dicker wurden.[119]
Eine Folge der reduzierten Behaarung war, dass die nunmehr weitgehend ungeschützte Haut der intensiven afrikanischen Sonneneinstrahlung ausgesetzt war: „Um die schädliche UV-Strahlung abzuhalten, ‚erfand‘ der Körper die Produktion von Melanin und damit die dunklere Hautfarbe, die es den Menschen ermöglichte, in diesen Breitengraden überhaupt überleben zu können.“[120] Pigmentierte Haut verhindert unter anderem, dass die Folsäure-Versorgung des Körpers durch ein Übermaß an UV-Strahlung beeinträchtigt wird.[121] Nach Berechnungen von Nina Jablonski (California Academy of Sciences) ist die Hautfarbe relativ leicht veränderbar, so dass sich ein Wechsel von hell nach dunkel bzw. von dunkel nach hell innerhalb von nur 100 bis 200 Generationen vollziehen kann.[122] Daher sei die Hautfarbe „wertlos für das Bestimmen der stammesgeschichtlichen Verwandtschaft“ von heute lebenden Populationen.[123]
Eine weitere Folge der reduzierten Behaarung war, dass die sichtbar gewordene Haut stärker als zuvor durch Verhornung geschützt werden musste: „Vergleiche des menschlichen und des Schimpansengenoms zeigten, dass wir uns von unseren nächsten Verwandten gerade auch in jenen Genen deutlich unterscheiden, deren Proteine über Hauteigenschaften bestimmen.“[115] Ferner konnte die Färbung der Haut zu einem sozialen Signal werden und beim anatomisch modernen Menschen auch der innerartlichen Kommunikation dienen, indem emotionale Zustände wie Angst oder Wut mit Erbleichen oder Erröten einhergehen. Zudem verlagerten sich Signale über emotionale Zustände vom gesträubten Haar hin zu einem komplexen Mienenspiel.
Es ist zudem „offensichtlich, dass Auftreten und langsame Zunahme der Schambehaarung in der Pubertät die Geschlechtsreife signalisiert.“[124]
Sozialverhalten
Der Paläoanthropologe Richard Leakey beschrieb das Sozialverhalten der Vorfahren des Menschen, die vor sieben Millionen Jahren lebten, wie folgt: „Statt als Familiengruppen in nomadischen Verbänden zu leben wie heutige Jäger und Sammler, lebten die ersten Menschen wahrscheinlich wie Mantelpaviane. Rudel von um die 30 Individuen streiften damals in koordinierter Weise durch ein ausgedehntes Gelände und kehrten nachts zu ihren bevorzugten Schlafplätzen in steilen Felswänden oder Baumgruppen zurück. Ausgewachsene Weibchen und ihr Nachwuchs machten den größten Teil des Rudels aus, während geschlechtsreife Männchen nur in geringer Zahl vorhanden waren.“[125]
Unser heutiges Sozialverhalten, das sich zum Beispiel in Empathie, sozialer Nähe / Distanz, Bereitschaft zu aggressivem Verhalten, Ängstlichkeit oder in den Reaktionen auf Stressoren zeigt, wird in erheblichem Maße durch Hormone wie Adrenalin, Oxytocin, Serotonin und Testosteron beeinflusst.[126] Einer 2018 publizierten Studie zufolge unterscheiden sich die Menschen von allen anderen Primaten u. a. durch eine – auch im Vergleich mit den anderen Menschenaffen – „dramatisch“ erhöhte Dopamin-Ausschüttung im Striatum und einer geringeren Freisetzung von Acetylcholin. Auch die Produktion von Serotonin und von Neuropeptid Y im Striatum ist erhöht. Diese Kombination von erhöhter und verringerter Hormonproduktion „begünstigt von außen gesteuertes Verhalten und verstärkt erheblich das Gespür für soziale Signale, die soziale Anpassung, Empathie und Altruismus fördern.“[127]
Kindheit
Der beim weiblichen Homo sapiens – im Verhältnis zur Körpergröße aller anderen Menschenartigen – sehr enge Beckenkanal ist insofern besonders bemerkenswert, als die Gehirngröße eines Neugeborenen bei Homo sapiens ohnehin nur ungefähr 28 Prozent der Gehirngröße des Erwachsenen beträgt. Ein Schimpanse wird hingegen bereits mit 40 Prozent der Gehirngröße seines ausgewachsenen Individuums geboren,[128] und auch der frühe Homo erectus wurde im Altpleistozän – vor mehr als einer Million Jahren – vermutlich noch mit rund 35 Prozent der Gehirngröße des Erwachsenen geboren,[63] obwohl dessen Beckenkanal bereits deutlich größer war als der von Australopithecus afarensis. Makaken werden sogar mit 70 Prozent des Gehirnvolumens ausgewachsener Artgenossen geboren.[129]
Vergleichsweise verlangsamt im Vergleich mit Homo erectus ist bei Homo sapiens auch das Größenwachstum des Gehirns in den Monaten nach der Geburt. Dies wurde abgeleitet von einem 1939 auf Java entdeckten Kinderschädel („Mojokerto child“; Sammlungsnummer: Perning I), den man 1994 mit Hilfe der 40Ar-39Ar-Methode auf 1,8 Millionen Jahre datierte. 2004 wurde dem Kind ein Lebensalter bei Todeseintritt von ungefähr einem Jahr und ein Gehirnvolumen von ungefähr 70 bis 90 Prozent eines Erwachsenen zugeschrieben; zum Vergleich: Kinder von Homo sapiens haben im Alter von einem Jahr erst ungefähr 50 Prozent des Gehirnvolumens eines Erwachsenen.[129]
Hieraus können zwei evolutionäre Trends für die Entwicklungslinie abgeleitet werden, die zu den heute lebenden Menschen führt: Zum einen vergrößerte sich der Beckenkanal, was auf den Durchtritt eines schon vor der Geburt immer größer gewordenen Gehirns schließen lässt;[130] zum anderen wurde das Gehirn – im Verhältnis zu seiner Größe beim Erwachsenen – bei der Geburt immer kleiner. Das Gehirnwachstum wurde somit in erheblichem Maße in die Zeit nach der Geburt verlegt, was eine deutliche Verlängerung der Kindheit und der mit ihr verbundenen, verlängerten sozialen Fürsorge durch Erwachsene schon vor 160.000 Jahren,[131] vermutlich sogar noch früher,[132] zur Folge hatte: Die Phase von Kindheit, Jugend und Adoleszenz – die zugleich eine Phase der Erziehung und des intensiven sozialen Lernens ist – dauert beim anatomisch modernen Menschen doppelt so lang wie bei den Schimpansen und führte zu einer Verlängerung des Intervalls zwischen zwei Geburten. Auch im Vergleich mit Homo erectus[133] und mit den Neandertalern war die Entwicklungsgeschwindigkeit eines Kindes von Homo sapiens wesentlich langsamer.[134]
Lebenserwartung
| Taxon | Dauer der Trächtigkeit (Tage) | Lebens- erwartung (Jahre) |
|---|---|---|
| Lemuren | 120–135 | 14–15 |
| Makaken | 165 | 27–28 |
| Gibbons | 210 | 30–40 |
| Schimpansen | 228 | 40–50 |
| Menschen | 266 | > 70[135] |
Zu den fortpflanzungsbiologischen Besonderheiten der Primaten-Evolution gehört, dass sich nicht nur die Kindheit, sondern auch die vorgeburtliche Phase (die Dauer der Trächtigkeit) und insgesamt die Lebenserwartung im Verlauf der Stammesgeschichte verlängert haben (siehe Tabelle[136]).
Die Tendenz zu einer verlängerten Lebensspanne ging vermutlich einher mit speziellen genetischen Anpassungen zur Abwehr von potentiellen Krankheitserregern. Dies wurde unter anderem abgeleitet aus einer Studie zur Funktionsweise des Apolipoprotein E. Dessen nur beim Menschen vorhandene Variante ApoE3 trägt maßgeblich dazu bei, dass Menschen weniger empfindlich auf Entzündungen und Infektionen reagieren als zum Beispiel Schimpansen.[137]
Eine weitere Konsequenz der gestiegenen Lebenserwartung war – so wird häufig argumentiert[138][139] – das Entstehen der Menopause: „Um für die Nachkommen von Müttern in fortgeschrittenem Alter die Wahrscheinlichkeit zu erhöhen, den Tod der Mutter zu überleben, entwickelten sich neue Reproduktionsstrategien, d. h. ältere Frauen gebären nicht selbst noch Kinder, sondern investieren in die Fürsorge des Nachwuchses der eigenen Tochter. Die ‚Erfindung der Großmutter‘ stellt vermutlich die funktionale Zweckursache (= ultimate Ursache) der weiblichen Menopause dar.“[140] Tatsächlich wurde für Finnland und Kanada belegt, dass eine besonders lange Lebenszeit nach der Menopause mit einer besonders großen Zahl an Enkelkindern korreliert.[141]
Sexualität
Bei allen Säugetieren besteht das Sexualverhalten aus einer Abfolge von Aktionen und Reaktionen der Sexualpartner, die sich jeweils „sehr spezifisch gegenseitig verstärken. […] Das bedeutet, daß unter anderem das Sexualverhalten dieser Tiere nicht ‚instinktiv‘ ist, das heißt, nicht ausschließlich aus ihnen selbst heraus bestimmt.“[142] Vielmehr ist das Sexualverhalten dieser Tiere – und insbesondere der Menschenaffen – „in hohem Maß von Übung und Erfahrung“ abhängig. „Menschen ist die Fähigkeit zu bestimmten grundlegenden sexuellen Reaktionen angeboren, sie sind aber nicht spezifisch auf Paarung ‚programmiert‘. Sie sind daher fast ganz auf Beobachtung und Erfahrung angewiesen. Ihr Sexualverhalten ist außerordentlich variabel“.[142]
Während Emotionen wie Angst und Furcht sowie Traurigkeit und Melancholie heute bereits durch pharmazeutische Therapien beeinflusst werden können, sind die neurobiologischen und physiologischen Grundlagen der Emotion Liebe noch weitgehend unverstanden.[143]
Genetisch determinierte Besonderheiten
- Außerhalb von Zeiten der Schwangerschaft ständig bestehende Empfängnisbereitschaft[144]
- keine durch Beobachtung erkennbaren Merkmale für den Sexualzyklus[144]
- der direkten Ansicht verborgene primäre Geschlechtsorgane bei der erwachsenen Frau
- Geschlechtsverkehr weitgehend ohne Synchronisierung mit der Ovulation[144]
- Ausbildung von Brüsten bei erwachsenen Frauen unabhängig von einer Laktation, deren Größe vom Fettgewebe bestimmt wird, nicht vom Drüsengewebe; auch die auffällige Färbung der Brustwarzenregion und die Größe der Brustwarzenhöfe ist einzigartig unter den Säugetieren.
- Beginn der Fruchtbarkeit im Vergleich zu anderen (auch langlebigen) Primaten erheblich verzögert
- Beendigung der Fruchtbarkeit von Frauen lange vor ihrem Tod: Ab einem Alter von ca. 50 Jahren erleben Frauen durch die Wechseljahre ein Ende ihrer Fruchtbarkeit
- Hervorhebung der adulten primären Geschlechtsorgane durch deutlich abgesetzte Schambehaarung bei sonst geringer Behaarung
- Verlust des Penisknochens[145]
- Ausbildung eines für Primaten im erigierten Zustand außerordentlich großen Penis, der nicht (ohne Hilfsmittel) verborgen werden kann
Kulturell etablierte Besonderheiten
- Monogamie: In vielen Ethnien existieren mehr oder weniger langfristige Paarbeziehungen zwischen einer Frau und einem Mann, was jedoch eine Neigung beider Geschlechter zu ‚Seitensprüngen‘ keineswegs ausschließt. Es gibt aber auch Populationen, in denen Polygynie oder Polyandrie vorkommen und offiziell geduldet werden. Genetische Untersuchungen deuten darauf hin, dass bei den Vorfahren der heutigen Menschen über lange Zeitspannen hinweg Monogamie die übliche Form der Paarbeziehung war.[146] Dies hatte auch zur Folge, dass die Männer langfristig und unmittelbar für das Überleben der gemeinsamen Kinder mitverantwortlich wurden.[144]
- Vorschriften und Verbote von Sexualpraktiken in vielen (oder den meisten) Kultur- und Religionsvorschriften.
- Kopplung von Scham und Sexualität: Menschen sind die einzige Spezies, die Scham für Sexualität entwickeln kann; Geschlechtsverkehr findet üblicherweise unter Ausschluss der Öffentlichkeit statt, während Tiere in der Regel vor den Augen der Artgenossen kopulieren. Eine Reihe von Autoren vertritt die Position, dass der versteckte Eisprung, die Sexualität zum Vergnügen und die Privatheit des Sexualaktes Merkmale sind, die die Bindung des Mannes an eine Frau, d. h. die zur Kinderaufzucht notwendige langfristige wirtschaftliche Kooperation von Paaren begünstigt haben.
Sprechvermögen

Die Befähigung zu einer äußerst komplexen Artikulation unterscheidet den anatomisch modernen Menschen von allen anderen Menschenaffen. Wann sich das hierauf gründende Sprechvermögen entwickelte und welcher Selektionsdruck dies bewirkte, ist mangels fossiler Belege weitgehend unbekannt. Möglicherweise dienten die für das Sprechen erforderlichen komplexen Muskelbewegungen (schnelle und koordinierte Bewegungen der Lippen, des Unterkiefers und der Zunge) zunächst dem Mienenspiel, also der visuellen Kommunikation.[147]
Voraussetzung für das Entstehen des Sprechvermögens war unter anderem die Herausbildung eines unter den Primaten einzigartigen Vokaltrakts und dessen motorischer Kontrolle sowie die geistige Fähigkeit, mit einer endlichen Anzahl von Lauten eine unendliche Anzahl von Bezeichnungen zu erzeugen, indem die Laute in einer bestimmten Abfolge (Syntax) angeordnet werden: „Im Vergleich zu den Menschenaffen liegt der für die Spracherzeugung wichtige Kehlkopf tiefer und ist zudem in wichtigen Details, beispielsweise den Stimmbändern, anders konstruiert.“[148] Insbesondere die freie Beweglichkeit der Zunge trägt dazu bei, dass eine besonders große Vielfalt an Lauten erzeugt werden kann.[149]
Seit dem Fund des Zungenbeins eines Neandertalers im israelischen Karmelgebirge Mitte der 1980er-Jahre gilt es als gesichert, dass die anatomischen Voraussetzungen für sprachliche Kommunikation auch beim Neandertaler gegeben waren. Ob dies auch schon für den letzten gemeinsamen Vorfahren von Neandertaler und Homo sapiens gilt, ist hingegen unklar. Welche Bedeutung einer Mutation des für das Forkhead-Box-Protein P2 codierenden Gens zuzuschreiben ist – dem in den Massenmedien die Rolle eines „Sprachgens“ zugeschrieben wurde[150] – ist gleichfalls unklar. Einer paläogenetischen Studie zufolge soll es seit 200.000 Jahren in der heute beim Menschen nachweisbaren Form existieren.[151]
Stammesgeschichtlich wesentlich älter ist hingegen die Fähigkeit von Menschenaffen, Symbol-Kombinationen zu bilden und anderen Individuen mitzuteilen. Das haben beispielsweise seit den 1970er-Jahren die Forschungen von Roger Fouts an Schimpansen ergeben:[152]
„Sie haben also die auditiven und kognitiven Fähigkeiten, Sprache zu ‚verstehen‘, obwohl sie selbst nicht sprechen können. Aus diesen Experimenten ist zu schließen, daß das syntaktische und symbolische Verständnis in anderen Verhaltensbereichen evolviert worden ist, nämlich bei der sozialen Kognition. Mensch und nicht-menschliche Primaten unterscheiden sich hierin nicht fundamental.“[148]
Der wesentliche Unterschied zwischen menschlicher Sprache und den Lautäußerungen anderer Tiere ist die Grammatik, die es ermöglicht, komplexe Zusammenhänge darzustellen. Menschen sind nur in einer sensiblen Phase der Kleinkindzeit in der Lage, die Grammatik einer Sprache spontan vollständig zu erlernen und sie akzentfrei sprechen zu lernen. Kleinkinder, die in einer Umgebung aufwachsen, in der keine voll ausgebildete Sprache zur Kommunikation verwendet wird – zum Beispiel in Situationen, in denen in einem Pidgin kommuniziert wird –, machen daraus im Umgang miteinander spontan wieder eine Sprache mit allen grammatikalischen Funktionen – eine sogenannte Kreolsprache.[153] Steven Pinker leitete daraus die Vorstellung von einem „Sprachinstinkt“ ab, der recht weitgehend die Eigenarten natürlicher Sprachen vorgeben soll.[154] Im Gegensatz dazu sind Menschenaffen zwar in der Lage, einzelne Wörter zu erlernen und sie zusammenzusetzen, um neue Bedeutungen auszudrücken, können aber keine grammatisch korrekten Sätze bauen, um komplexere Bedeutungszusammenhänge darzustellen.[155]
Eine Hypothese, die von vielen Forschern vertreten wird, besagt, dass Kommunikation durch Laute allmählich die soziale Fellpflege ersetzt habe und – wie diese – zum Zusammenhalt der Gruppe beitrug,[156] das heißt, die Sprechfähigkeit entstand „in einem hochgradig sozialen, potentiell kooperativen Kontext, verknüpft und einhergehend mit mindestens drei Merkmalen: gemeinsame Aufmerksamkeit, gemeinsame Absichten und Theory of Mind.“[157]
Wann sich, unter anderem aufbauend auf diesen Fähigkeiten, den anatomischen Veränderungen des Vokaltrakts und der Ausbildung des heutigen Sprachzentrums, die lautliche Kommunikation zur Symbolsprache entwickelte, lässt sich nach heutigem Stand des Wissens erst dann klären, „wenn wir aus dem archäologischen Befund unmißverständliche Belege für syntaktische und symbolhafte, auf hohem Niveau angesiedelte sprachliche Fähigkeiten haben. Auf dem Homo-erectus-Stadium waren diese Qualifikationen wohl noch nicht erreicht.“[148]
Kulturell tradierte Merkmale
Zu den kulturell tradierten Merkmalen zählen beim Menschen unter anderem Geschichtlichkeit und Moral sowie die Weitergabe von Wissen durch Sprache (das heißt durch symbolische Kommunikation), die mit steigender Gruppengröße wesentlich komplexere Kooperation,[158] das Anfertigen von Kunstwerken und der Technikeinsatz. Prozesse der kulturellen Evolution werden seit den 1970er Jahren unter dem Begriff Kulturethologie erforscht.[159]
Für Informationen, die allein durch menschliches Bewusstsein verbreitet und vermehrt („repliziert“) werden, schlug der Evolutionsbiologe Richard Dawkins im Jahre 1976 das Konzept der Memetik vor. Damit wurde ein Pendant zum Gen entworfen, wobei der Grundgedanke darin besteht, dass sich bestimmte Informationen („Meme“) aufgrund ihrer Vorteilhaftigkeit replizieren und gegenüber anderen Informationen durchsetzen, ebenso wie das „erfolgreiche“ Gene tun.[160] In diesem Sinne können Traditionen der Werkzeugherstellung (Beispiel: Faustkeil), Arbeitsprozesse (Beispiel: Feuer, Ackerbau) oder Rituale früher Hominiden als Meme bzw. Memplexe („Mem-Komplexe“) bezeichnet werden, die sich aufgrund ihrer Vorteilhaftigkeit von Gehirn zu Gehirn replizieren.[161]
Der anatomisch moderne Mensch ist allerdings nicht die einzige Art, die erlernte Eigenschaften an die nachfolgende Generation weitergibt.[162] Ein bekanntes Beispiel ist das „Kartoffelwaschen“ einer Population von Japanmakaken auf der Insel Kōjima. In einer Übersichtsarbeit von Andrew Whiten und Jane Goodall wurden 1999 mehrere Dutzend gruppenspezifisch tradierte Verhaltensweisen bei Schimpansen nachgewiesen, darunter auch Werkzeuggebrauch bei Schimpansen,[163] 2001 wurde beispielsweise „Kultur bei Walen und Delfinen“ beschrieben,[164] 2003 bei Orang-Utans[165] und bei Weißschulterkapuzinern.[166] Ein wesentlicher Unterschied zwischen Tieren und dem Menschen besteht daher nicht in der Existenz von kulturell tradierten Merkmalen, sondern darin, dass Jungtiere sich nur durch Beobachtungslernen Verhaltensweisen ihrer Eltern aneignen, während Menschen ihr Wissen auch aktiver, durch Instruktionen (‚Lehrer‘ und ‚Schüler‘) weitergeben.
Gesprochene Sprache
Die größte genetische Vielfalt der Menschheit wurde in afrikanischen Populationen südlich der Sahara nachgewiesen.[167] In ähnlicher Weise wie die genetische und – hiermit verbunden – die phänotypische Vielfalt mit Abstand von Afrika abnimmt, da zusätzliche Populationen in der außerafrikanischen Welt meist nur von wenigen Individuen gegründet wurden, verringert sich auch die Zahl der benutzten Phoneme.[168] Hieraus wurde abgeleitet, dass der Ursprung der ersten tradierten menschlichen Sprachen (der Sprachursprung) in Westafrika, Zentralafrika oder im südlichen Afrika gelegen habe.
Zur Struktur der ersten Sprachen – sogenannter Protosprachen – gibt es zahlreiche Hypothesen. Beispielsweise wird von einigen Forschern angenommen, dass anfangs einzelne Wörter ohne Anordnung in syntaktischen Strukturen (ohne Anordnung in „Sätzen“) verwendet wurden; Einigkeit in der Paläolinguistik herrscht darüber, dass gesprochene Wörter anfangs vor allem auf Objekte und Ereignisse verwiesen und nicht auf Ideen.[149] Die auffällige Häufung von Tonsprachen, bei denen mit einer Änderung der Tonhöhe oder des Tonverlaufs in einer Silbe in der Regel auch eine Änderung der Bedeutung des entsprechenden Wortes (oder des Morphems) einhergeht, in tropischen und subtropischen Regionen wird durch die Hypothese erklärt, dass solche Sprachen sich in einer weniger feuchten Umgebung nicht haben herausbilden können, da trockene Luft es dem Kehlkopf erschwere, den richtigen Ton zu treffen.[169]
Nach der Analyse von 2200 lebenden Sprachen und toten Sprachen publizierten Murray Gell-Mann und Merritt Ruhlen 2011 eine Hypothese zum ursprünglichen Satzbau. Demnach ordnet die Mehrzahl der lebenden Sprachen ihre Satzglieder in der Reihenfolge Subjekt – Verb – Objekt, also: „Ich – sehe – Löwen“; die meisten toten Sprachen hingegen ordneten die Satzglieder in der Reihenfolge Subjekt – Objekt – Verb, „Ich – Löwen – sehe“. Gell-Mann und Ruhlen zufolge ließen sich alle ‚Subjekt-Verb-Objekt-Sprachen‘ von ‚Subjekt-Objekt-Verb-Sprachen‘ ableiten, es existiere aber kein einziger Hinweis auf eine gegensätzliche Veränderung des Satzbaus.[170] Dies wurde von Merritt Ruhlen als Beleg dafür interpretiert, „dass die mutmaßliche Ursprache eine ‚Subjekt-Objekt-Verb-Wortstellung‘ hatte.“[171]
Die ältesten, über das afrikanische und europäische Siedlungsgebiet des Homo sapiens verteilten, gezeichneten Symbole – zum Beispiel Kreise, Spiralen, Punkte, Linien, offene und geschlossene Dreiecke sowie Hände – sind rund 35.000 Jahre alt;[172] unklar ist aber, ob diese Symbole als frühe Belege für die Anfänge einer geschriebenen Sprache interpretiert werden können.
Werkzeuggebrauch
Für die Abgrenzung der Gattung Homo von den Australopithecinen wurde lange Zeit Werkzeugnutzung als wichtiges Definitionskriterium angesehen.[173] Dies änderte sich erst, nachdem Jane Goodall 1964 den Werkzeuggebrauch bei Tieren nachgewiesen hatte.[174] Es wird vermutet, dass – vergleichbar den heute lebenden Schimpansen – von Australopithecinen auch bearbeitete Holzstücke verwendet wurden, die wegen ihrer Vergänglichkeit archäologisch aber nicht nachweisbar sind.[175][176]
In Kenia wurden an der Fundstelle Lomekwi 3,3 Millionen Jahre alte Steinwerkzeuge (Geröllgeräte) entdeckt, die 2015 von ihren Entdeckern als Lomekwian-Typ bezeichnet wurden. Die ältesten Steinwerkzeuge vom Oldowan-Typ sind bis zu 2,9 Millionen Jahre alt und stammen aus der Fundstätte Nyayanga in Kenia.[177] Aus der gleichen Fundschicht traten zudem zwei große Backenzähne zutage, die Paranthropus zugeschrieben wurden. Aus Äthiopien stammen bis zu 2,6 Millionen Jahre alte Funde, die somit ebenfalls älter sind als die frühesten Vertreter der Gattung Homo.[178][179] Sie wurden – wie auch die Funde von Nyayanga – in Verbindung mit Knochen gefunden, auf denen Schnittspuren von der Bearbeitung mit Steinwerkzeugen erhalten sind und die daher als relativ gesichert gelten.[179] Urheber dieser Werkzeuge ist aus heutiger Quellenlage Australopithecus garhi. 3,4 Millionen Jahre alte Ritzungen an zwei Wildtierknochen aus Dikika wurden ebenfalls auf Steinwerkzeuge zurückgeführt und Australopithecus afarensis zugeschrieben;[180] aus der gleichen Fundschicht ist hier allerdings bisher kein Steingerät bekannt, weswegen die Interpretation der Ritzungen als Schnittspuren umstritten ist.[181] In Südafrika entdeckte, 500.000 Jahre alte Steinartefakte wurden im Jahr 2012 als Projektilspitzen interpretiert; sollte diese Deutung korrekt sein, wären die aus der Fundstelle Kathu Pan 1 (KP1) stammenden Funde die ältesten Belege für die Nutzung von Speeren.[182]
Eine überzeugende Korrelation von biologischer Entwicklung und dem vermuteten Selektionsvorteil durch Nutzung einfacher Geröllgeräte konnte bisher nicht nachgewiesen werden. Stattdessen wird die Einnischung aufgrund des regional sehr unterschiedlichen Nahrungsangebots als möglicherweise wichtigste Triebkraft der Speziation angesehen.[183] Dieser Prozess begann vor mindestens 3 Millionen Jahren, wobei sich langfristig die Omnivoren (Generalisten) durchsetzten. Für jüngere Homo-sapiens-Populationen gilt es hingegen weiterhin als wahrscheinlich, dass die Vermittlung spezieller Herstellungstechniken für Steingerät an die jeweils nachfolgende Generation unter anderem Auswirkungen auf Sozialverhalten und Lernvermögen hatte[184] und auch die Befähigung zu planvollem Handeln förderte.[185]
Spätestens vor 72.000 Jahren wurden Steine aus einem bestimmten verkieselten Gestein (Silcrete), aus denen Werkzeuge mit scharfen Kanten hergestellt werden sollten, routinemäßig ins Feuer gelegt; nach der Erhitzung konnte man die Abschläge leichter vom Kern trennen.[186]
Auch die Domestizierung des Wolfes wurde dahingehend interpretiert, dass er zu einem ‚(Jagd-)Werkzeug‘ des Menschen geformt wurde.[187]
Kleidung
488 Flachsfasern – darunter 58 mutmaßlich gefärbte Fasern – gelten als die ältesten Belege für das Anfertigen von Kleidung. Sie stammen aus der Dzudzuana-Höhle in Georgien und wurden 2007 und 2008 aus einer Bodenschicht geborgen, deren Alter auf 36.000 bis 31.000 Jahre (yr B.P. ka) datiert wurde.[188] Nur unwesentlich jünger sind Faserfunde – vermutlich von Brennnesseln – aus Dolní Věstonice (Tschechien), die 32.000 bis 29.000 Jahre alt sind und ebenfalls von Cro-Magnon-Menschen (Homo sapiens) stammen.[189]
Wann die ersten Kleidungsstücke (vermutlich aus Fellen) angefertigt wurden, ist unbekannt, da es keine noch älteren archäologischen Funde gibt. Allerdings haben Genanalysen von Menschenläusen zu dem Schluss geführt, dass Homo sapiens bereits vor mindestens 70.000 Jahren, möglicherweise sogar schon vor 170.000 Jahren Kleidung trug.[111][112] Als Hinweis auf eine mögliche Verarbeitung von Leder vor rund 40.000 Jahren wurde zudem 2023 der Fund eines Knochens im Nordosten Spaniens interpretiert, der eine Reihe gleichförmiger Vertiefungen aufweist und als Unterlage gedient haben könnte, um Leder zu durchbohren und für das Vernähen vorzubereiten.[190]
Spekuliert wird in Fachkreisen ferner darüber, dass auch die sehr viel früher stattgefunden habende Ausbreitung von Homo heidelbergensis und der Neandertaler im nördlichen Eurasien „eine kälteabweisende Kleidung“ erforderte, „um auch bei monatelang unter 10 Grad Celsius fallenden Temperaturen ohne bleibende und für kleine Kinder durch anhaltende Unterkühlung unfehlbar tödliche Schäden handlungsfähig zu bleiben.“[191]
Ernährung
Nach heutigem Kenntnisstand ist der anatomisch moderne Mensch „von Natur aus“ weder ein reiner „Fleischfresser“ (Carnivore) noch ein reiner „Pflanzenfresser“ (Herbivore), sondern ein „Allesfresser“ (Omnivore).[192] Für die frühesten zur Gattung Homo gestellten Fossilien wurde nachgewiesen, dass sie sich – ähnlich wie Australopithecus africanus und Paranthropus robustus – zu mehr als 50 Prozent ihrer täglichen Zufuhr an Nahrungsenergie von C3-Pflanzen und zu einem weiteren erheblichen Anteil von C4-Pflanzen ernährten.[193]
Der Gebrauch von Werkzeugen hat später die Ernährung des Menschen wesentlich beeinflusst und in der Folge auch die Gestalt der Knochenplatten des Kopfes, der Kiefer und der Zähne verändert. Wenn man die Zeitspanne, die Affen täglich für die Nahrungsaufnahme aufwenden, auf die Körpermasse des Menschen umrechnet, würde man erwarten, dass Homo sapiens 48 Prozent der täglichen Aktivität hierfür verwendet; tatsächlich sind es aber nur knapp fünf Prozent.[194] Insbesondere die im Vergleich zu Homo habilis und Homo rudolfensis verkleinerten Backenzähne – vor rund 1,9 Millionen Jahren bei Homo erectus und später beim Neandertaler und bei Homo sapiens – können am ehesten als Folge von „verarbeiteter“ Nahrung interpretiert werden. 1,95 Millionen Jahre alte Knochenfunde aus Kenia bezeugen beispielsweise, dass damals bereits neben Antilopenfleisch auch das Fleisch zahlreicher im Wasser lebender Tiere – darunter Schildkröten, Krokodile und Fische – verzehrt wurde.[183] Australopithecus afarensis hatte sich, vergleichbar den heutigen Pavianen, noch von einer überwiegend pflanzlichen, aber wenig hartfaserigen Kost ernährt,[195] während die Individuen der Gattung Homo bereits vor zwei Millionen Jahren zunehmend proteinreichere Kost verzehrten – was wiederum die allmähliche Vergrößerung des Gehirns begünstigte.[196]

Als gesichert gilt beim derzeitigen Forschungsstand, dass Homo erectus als erster die Beherrschung des Feuers lernte, was eine unter allen Lebewesen exklusive Fähigkeit der Gattung Homo ist; jedoch scheinen auch Schimpansen gekochte Nahrung zu bevorzugen.[197] Die älteste unumstrittene Fundstelle mit verbrannten menschlichen Nahrungsresten ist Gesher Benot Ya’aqov im Norden Israels, die etwa 790.000 Jahre alt ist.[198] In Europa hingegen stammt der älteste Nachweis von Feuerstellen aus der Zeit um 400.000 vor heute (Schöningen in Deutschland und Beeches Pit in England), während ältere Fundstellen homininer Fossilien wie die Höhle von Arago in Frankreich oder die Höhlen in der Sierra de Atapuerca (Sima del Elefante, Gran Dolina) keine Spuren von Feuergebrauch aufweisen; trotz Temperaturen von zeitweise unter Null Grad hat Homo erectus demnach Europa ohne Wärmeerzeugung durch Feuerstellen besiedeln können.[199] Auch das Erhitzen der Nahrung hat Homo erectus demzufolge in Europa erst relativ spät praktiziert, Homo sapiens hingegen vermutlich seit Beginn seiner Existenz als unterscheidbare Art.[200]
Auch heute noch ist der Mensch ein „Allesfresser“ (Omnivore); umstritten ist allerdings, welcher Anteil der Nahrungsaufnahme in vormodernen Gesellschaften auf Fleisch und auf Pflanzenkost entfiel:[201][202] Während sich die Ewenken in Sibirien und die Eskimos überwiegend fleischlich ernährten, lebten die Völker in den Anden in erster Linie von pflanzlichen Nahrungsmitteln; bei der Mehrheit der heute noch lebenden Jäger-und-Sammler-Völker stammt allerdings weit über die Hälfte der Kost von Tieren.[203]
Für die vor 30.000 Jahren in Europa lebenden Männer wurde die Körpergröße auf im Mittel 1,72 Meter geschätzt; später – offenbar infolge der Ausweitung der Landwirtschaft – verschlechterte sich die Ernährungslage, so dass die Körpergröße bis vor 4000 Jahren stetig abnahm. Eine weitere Größenabnahme ereignete sich im Mittelalter. Erst seit etwa 100 Jahren hat die Körpergröße der männlichen Europäer wieder den Ausgangswert erreicht und ihn in jüngster Zeit überschritten.[204]
Kunstwerke

Als die frühesten Zeugnisse symbolischer Kommunikation gelten mit geometrischen Gravuren verzierte Ockerstücke aus der Blombos-Höhle in Südafrika, die auf etwa 77.000 Jahre datiert wurden.[205] Noch 5000 Jahre älter sind durchbohrte Schneckenhäuser (Nassarius gibbosulus) aus der Grotte des Pigeons bei Taforalt (Region Oujda, Marokko), die mit anhaftenden Ockerresten gefunden wurden.[206] Ungefähr 60.000 Jahre alt sind 270 Fragmente von Straußeneiern, die gleichfalls in Südafrika – in der Diepkloof-Höhle – entdeckt wurden und ebenfalls geometrische Muster (Schraffuren, parallele und sich kreuzende Linien) aufweisen.[207] Mit einem Alter von unter 40.000 Jahren wesentlich jünger sind die aus Europa bekannten Höhlenmalereien sowie Objekte wie beispielsweise die Löwenmenschen und die Venus vom Hohlen Fels.
Soziale Fürsorge
Soziale Fürsorge, das heißt die altruistische Versorgung von nur eingeschränkt handlungsfähigen Individuen durch andere Mitglieder ihrer Gruppe, ist bei den heute lebenden Menschenaffen weitgehend beschränkt auf die Ernährung und den Schutz von Jungtieren. Die Merkmale einiger Fossilien der Gattung Homo wurden jedoch dahingehend interpretiert, dass sie deutliche Hinweise auf soziale Fürsorge zugunsten von betagten Erwachsenen zeigen. So wurde in Georgien unter den homininen Fossilien von Dmanissi ein rund 1,8 Millionen Jahre alter, zahnloser Schädel mit zugehörigem unbezahntem Unterkiefer entdeckt, dessen „verheilte“ Zahnfächer den Schluss zulassen, dass das Individuum – obwohl es grobe Nahrungsmittel nicht mehr zerkauen konnte – mit stark zerkleinerten Nahrungsmitteln versorgt und trotz seiner Behinderung sozial integriert gewesen sein muss.[208]
Ähnlich interpretiert wird der Fund eines rund 500.000 Jahre alten Homo heidelbergensis aus der Sierra de Atapuerca in Spanien: Die männliche Wirbelsäule zeige Anzeichen einer ausgeprägten Kyphose (eines „Buckels“), von Spondylolisthesis und von Morbus Baastrup, so dass dieses Individuum sich vermutlich nur noch mit einem „Gehstock“ habe aufrecht fortbewegen können. Weder habe es aufgrund dieser schmerzhaften Krankheiten an der Jagd teilnehmen noch schwere Lasten tragen können, so dass es vermutlich in besonderem Maße auf die soziale Fürsorge seiner Gruppe angewiesen gewesen sei.[209]
Spiritualität und Religiosität
Schon Charles Darwin hatte vermutet, die Neigung des Menschen zu Spiritualität und Religiosität habe sich erst im Verlauf der jüngeren Stammesgeschichte herausgebildet:
- „Wir haben keinen Beweis dafür, dass dem Menschen von seinem Ursprunge an der veredelnde Glaube an die Existenz eines allmächtigen Gottes eigen war.“[210]
Darwin deutete diese Neigung als Folge bestimmter kognitiver, also letztlich durch die Verschaltung der Nervenzelle im Gehirn ermöglichter Fähigkeiten:
- „Sobald die bedeutungsvollen Fähigkeiten der Einbildungskraft, Verwunderung und Neugierde, in Verbindung mit einem Vermögen nachzudenken, theilweise entwickelt waren, wird der Mensch ganz von selbst gesucht haben, das was um ihn her vorgeht zu verstehen, und wird auch über seine eigene Existenz dunkel zu speculiren begonnen haben.“[211]
Heutige Kulturanthropologen führen die Existenz von Spiritualität und Religiosität darauf zurück, dass sie kooperatives Verhalten zwischen gleichgesinnten Fremden fördern und dadurch zum Entstehen und zum Erhalten stabiler sozialer Gruppen beitragen;[212] ungeklärt ist jedoch, ob dies im Sinne einer evolutionären Anpassung oder – vergleichbar der Musikalität – als ‚Begleiterscheinung‘ anderer kognitiver Fähigkeiten zu deuten ist.[213][214][215]
In welcher Epoche diese kognitiven Fähigkeiten erstmals auftraten, ist umstritten: Einige Forscher stellen einen Zusammenhang mit den ältesten, sicher datierten Bestattungen vor 95.000 Jahren in der Qafzeh-Höhle (Israel) her;[216] andere mit den ältesten sicher datierten Kunstwerken wie der Venus vom Hohlefels vor rund 35.000 Jahren.[217][218]
Die neurophysiologische Basis geistiger Fähigkeiten ist bislang weitestgehend unerforscht, jedoch gibt es zumindest im Hinblick auf Spiritualität erste Hinweise; so wies Vilayanur S. Ramachandran beispielsweise darauf hin: „Jeder Medizinstudent lernt, dass Patienten mit epileptischen Anfällen, die [im linken Schläfenlappen] entstehen, während der Anfälle oft intensive spirituelle Erfahrungen haben…“[219] Ramachandran stellte ferner die Einzigartigkeit solcher Erfahrungen heraus:
- „Wir Menschen besitzen viele Eigenschaften, die nur unserer Art eigen sind, aber keine von ihnen ist so rätselhaft wie die Religion – unser Hang, an eine höhere Macht zu glauben, die die Welt der Erscheinungen transzendiert. Es ist äußerst unwahrscheinlich, dass irgendein anderes Geschöpf nach ‚dem Sinn des Ganzen‘ fragen kann.“[219]
Literatur
- Winfried Henke, Hartmut Rothe: Menschwerdung. Fischer Taschenbuch Verlag, Frankfurt am Main 2003, ISBN 3-596-15554-1.
- Thomas Junker: Die Evolution des Menschen. 3., völlig überarbeitete Auflage. C. H. Beck, München 2018, ISBN 978-3-406-72276-9.
- Alice Roberts: Die Anfänge der Menschheit. Vom aufrechten Gang bis zu den frühen Hochkulturen. Dorling Kindersley Verlag, München 2012, ISBN 978-3-8310-2223-6.
- Andra Meneganzin, Telmo Pievani und Giorgio Manzi: Pan-Africanism vs. single-origin of Homo sapiens: Putting the debate in the light of evolutionary biology. Review in: Evolutionary Anthropology. Band 31, Nr. 4, 2022, S. 199–212, doi:10.1002/evan.21955. (freier Volltext)
Weblinks
- Wildheit in uns – evolutives Erbe des Menschen. (Memento vom 17. März 2008 im Internet Archive) Vortrag von Inge Schröder, November 1998. Die Autorin ist habilitierte Anthropologin am Wissenschaftszentrum Kiel.
Belege
- Melinda C. Mills und Iain Mathieson: The challenge of detecting recent natural selection in human populations. In: PNAS. Band 119, Nr. 15, März 2022, e2203237119, doi:10.1073/pnas.2203237119 (freier Volltext).
- Stephen C. Stearns et al.: Measuring selection in contemporary human populations. In: Nature Reviews Genetics. Band 11, 2010, S. 611–622, doi:10.1038/nrg2831.
Emmanuel Milot et al.: Evidence for evolution in response to natural selection in a contemporary human population. In: PNAS. Band 108, Nr. 41, 2011, S. 17040–17045, doi:10.1073/pnas.1104210108.
Jaleal S. Sanjak et al.: Evidence of directional and stabilizing selection in contemporary humans. In: PNAS. Band 115, Nr. 1, 2018, S. 151–156, doi:10.1073/pnas.1707227114. - Katherine M. Kirk et al.: Natural selection and quantitative genetics of life-history traits in western women: a twin study. In: Evolution. Band 55, Nr. 2, 2001, S. 423–435, doi:10.1111/j.0014-3820.2001.tb01304.x.
Alexandre Courtiol et al.: Natural and sexual selection in a monogamous historical human population. In: PNAS. Band 109, Nr. 21, 2012, S. 8044–8049, doi:10.1073/pnas.1118174109. - Alexandre Courtiol et al.: The Demographic Transition Influences Variance in Fitness and Selection on Height and BMI in Rural Gambia. In: Current Biology. Band 23, Nr. 10, 2013, S. 884–889, doi:10.1016/j.cub.2013.04.006.
- Sandra Wild et al.: Direct evidence for positive selection of skin, hair, and eye pigmentation in Europeans during the last 5,000 y. In: PNAS. Band 111, Nr. 13, 2014, S. 4832–4837, doi:10.1073/pnas.1316513111.
Starke positive Selektion hat Aussehen der Europäer in den letzten 5.000 Jahren verändert. Auf: idw-online.de vom 10. März 2014.
Humans are still evolving – and we can watch it happen. Auf: sciencemag.org vom 17. Mai 2016. - C. Owen Lovejoy: The Origin of Man. In: Science. Band 211, 1981, S. 341–350, doi:10.1126/science.211.4480.341 – „Five characters separate man from other hominoids – a large neocortex, bipedality, reduced anterior dentition with molar dominance, material culture, and unique sexual and reproductive behavior.“
- Chris Stringer: Evolution: What makes a modern human. In: Nature. Band 485, 2012, S. 33–35, doi:10.1038/485033a.
- wörtlich: „large, linear bodies, elongated legs, large brain sizes, reduced sexual dimorphism, increased carnivory, and unique life history traits (e.g., extended ontogeny and longevity) as well as toolmaking and increased social cooperation.“ Zitiert aus: Susan C. Antón, Richard Potts und Leslie C. Aiello: Evolution of early Homo: An integrated biological perspective. In: Science. Band 345, Nr. 6192, 2014, doi:10.1126/science.1236828.
- Nina G. Jablonski: Human Skin Pigmentation as an Example of Adaptive Evolution. In: Proceedings of the American Philosophical Society. Band 156, Nr. 1, 2012, S. 45–57, Volltext (PDF). (Memento vom 30. April 2015 im Internet Archive)
- Rolf M. Quam et al.: Early hominin auditory ossicles from South Africa. In: PNAS. Band 110, Nr. 22, 2013, S. 8847–8851, doi:10.1073/pnas.1303375110.
- Carol V. Warda et al.: Thoracic vertebral count and thoracolumbar transition in Australopithecus afarensis. In: PNAS. Band 114, Nr. 23, 2017, S. 6000–6004, doi:10.1073/pnas.1702229114.
- Manuel Will und Jay T. Stock: Spatial and temporal variation of body size among early Homo. In: Journal of Human Evolution. Band 82, 2015, S. 15–33, doi:10.1016/j.jhevol.2015.02.009.
- Bogusław Pawłowski: Putative Selection Pressures Acting on the Early Hominins. In: Winfried Henke, Ian Tattersall (Hrsg.): Handbook of Palaeoanthropology. Band 3, Springer, Berlin/ Heidelberg/ New York 2007, ISBN 978-3-540-32474-4, Kapitel 3, S. 1410–1440.
- Zur Übersicht siehe: W. E. H. Harcourt-Smith, Leslie C. Aiello: Fossils, feet and the evolution of human bipedal locomotion. In: Journal of Anatomy. Band 204, Nr. 5, 2004, S. 403–416, doi:10.1111/j.0021-8782.2004.00296.x, PMC 1571304 (freier Volltext).
- C. Owen Lovejoy: Evolution of Human Walking. In: Scientific American. November 1988, S. 118–125.
- Richard Leakey: The origin of humankind. Phoenix, a division of Orion Books Ltd., 1995, S. 13.
- The Transforming Leap, from Four Legs to Two. Auf dem Webserver des Public Broadcasting Service, Stand: September 1995.
- Winfried Henke, Hartmut Rothe: Stammesgeschichte des Menschen. Springer Verlag, Berlin 1999, S. 55.
- Peter J. Fernández, Carrie S. Mongle, Louise Leakey et al: Evolution and function of the hominin forefoot. In: PNAS. Band 115, Nr. 35, 2028, S. 8746–8751, doi:10.1073/pnas.1800818115.
- Yinan Zhang et al.: Lufengpithecus inner ear provides evidence of a common locomotor repertoire ancestral to human bipedalism. In: The Innovation. Onlineveröffentlichung vom 14. Februar 2024, doi:10.1016/j.xinn.2024.100580.
How did humans learn to walk? New evolutionary study offers an earful. Auf: eurekalert.org vom 29. Januar 2024. - Mary Leakey et al: Pliocene footprints in the Laetoli beds at Laetoli, northern Tanzania. In: Nature. Band 278, 1979, S. 317–323, doi:10.1038/278317a0.
- David A. Raichlen et al.: Laetoli footprints preserve earliest direct evidence of human-like bipedal biomechanics. In: PLoS ONE. Band 5, Nr. 3: e9769. 2010; doi:10.1371/journal.pone.0009769.
Vormensch mit durchgedrücktem Kreuz. Auf: wissenschaft.de vom 20. März 2010. - Robin H. Crompton et al.: Human-like external function of the foot, and fully upright gait, confirmed in the 3.66 million year old Laetoli hominin footprints by topographic statistics, experimental footprint-formation and computer simulation. In: Journal of the Royal Society Interface. Band 9, Nr. 69, 2011, S. 707–719, doi:10.1098/rsif.2011.0258.
- Vivek V. Venkataraman et al.: Tree climbing and human evolution. In: PNAS. Band 110, Nr. 4, 2013, S. 1237–1242, doi:10.1073/pnas.1208717110, Volltext (PDF).
- Did Lucy walk, climb, or both? Australopithecine ancestors – arboreal versus terrestrial habitat and locomotion. Auf: eurekalert.org vom 31. Dezember 2012.
- Leoni Georgiou et al.: Evidence for habitual climbing in a Pleistocene hominin in South Africa. In: PNAS. Band 117, Nr. 15, 2020, S. 8416–8423, doi:10.1073/pnas.1914481117.
Evidence of fossil hominin locomotion. Auf: eurekalert.org vom 30. März 2020. - Carol V. Ward, William H. Kimbel und Donald C. Johanson: Complete Fourth Metatarsal and Arches in the Foot of Australopithecus afarensis. In: Science. Band 331, Nr. 6018, 2011, S. 750–753, doi:10.1126/science.1201463.
- „The Ileret prints show that by 1.5 Ma, hominins had evolved an essentially modern human foot function and style of bipedal locomotion.“ Matthew R. Bennett et al.: Early Hominin Foot Morphology Based on 1.5-Million-Year-Old Footprints from Ileret, Kenya. In: Science. Band 323, 2009, S. 1197–1201, doi:10.1126/science.1168132. – In: New Scientist VOM 23. Mai 2009, S. 24, wies Richard Leakey darauf hin, dass die Zuordnung der Spuren zu Homo erectus nicht zwingend sei, da zur gleichen Zeit und in den gleichen afrikanischen Biotopen auch Paranthropus boisei und Homo habilis vorkamen.
- David R. Carrier: The Energetic Paradox of Human Running and Hominid Evolution. In: Current Anthropology. Band 25, Nr. 4, 1984, S. 483–495, doi:10.1086/203165, Volltext (PDF).
- Dennis M. Bramble, Daniel E. Lieberman: Endurance running and the evolution of Homo. In: Nature. Band 432, 2004, S. 345–352, doi:10.1038/nature03052.
- Charles Darwin: Die Abstammung des Menschen und die geschlechtliche Zuchtwahl, I. Band. 3. Auflage. E. Schweizerbart'sche Verlagshandlung (E. Koch), Stuttgart 1875, S. 65 und 67.
- Sherwood L. Washburn: Tools and human evolution. In: Scientific American. Band 203, Nr. 3, 1966, S. 63–75.
- George A. Bartholomew, Jr. und Joseph B. Birdsell: Ecology and the Protohominids. In: American Anthropologist. New Series. Band 55, Nr. 4, 1953, S. 481–498, doi:10.1525/aa.1953.55.4.02a00030.
- John A. Van Couvering: Eintrag Pliocene / Hominid Evolution in the Pliocene. In: Eric Delson, Ian Tattersall, John A. Van Couvering, Alison S. Brooks: Encyclopedia of Human Evolution and Prehistory. 2. Auflage. Routledge, New York 2000, ISBN 0-8153-1696-8, S. 576.
- Kaye E. Reed: Early hominid evolution and ecological change through the African Plio-Pleistocene. In: Journal of Human Evolution. Band 32, Nr. 2–3, 1997, S. 289–322, doi:10.1006/jhev.1996.0106.
- Margaret D. Rose: The process of bipedalization in hominids. In: Yves Coppens und Brigitte Senut (Hrsg.): Origine(s) de la bipédie chez les hominidés. Editions du CNRS, Paris 1991, S. 37–48.
- Robert A. Foley und Sarah Elton: Time and energy: the ecological context for the evolution of bipedalism. Kapitel 21 in: Elizabeth Strasser, John Fleagle, Alfred Rosenberger und Henry McHenry (Hrsg.): Primate locomotion: recent advances. Plenum Press, New York 1998, S. 419–433, doi:10.1007/978-1-4899-0092-0 21.
- Christopher L. Vaughan: Theories of bipedal walking: an odyssey. In: Journal of Biomechanics. Band 36, Nr. 4, 2003, S. 513–523, doi:10.1016/S0021-9290(02)00419-0, Volltext (PDF; 990 kB).
- Das Cover von Science vom 1. Juni 2007 enthält ein ähnliches Foto eines „stehenden“ Orang-Utans aus Sumatra, siehe sciencemag.org.
- S. K. S. Thorpe et al.: Origin of Human Bipedalism As an Adaptation for Locomotion on Flexible Branches. In: Science. Band 316, 2007, S. 1328–1331, doi:10.1126/science.1140799
Aufrecht auf dem Ast. Auf: sueddeutsche.de vom 17. Mai 2010. - C. Owen Lovejoy et al.: The Pelvis and Femur of Ardipithecus ramidus: The Emergence of Upright Walking. In: Science. Band 326, 2009, S. 71, 71e1–71e6, doi:10.1126/science.1175831.
C. Owen Lovejoy et al.: Careful Climbing in the Miocene: The Forelimbs of Ardipithecus ramidus and Humans Are Primitive. In: Science. Band 326, 2009, S. 70, 70e1–70e8, doi:10.1126/science.1175827.
C. Owen Lovejoy et al.: Combining Prehension and Propulsion: The Foot of Ardipithecus ramidus. In: Science. Band 326, 2009, S. 72, 72e1–72e8, doi:10.1126/science.1175832. - zitiert aus einem Interview („Sensationsfund Ardi – Attraktion statt Aggression“) in: Süddeutsche Zeitung vom 2. Oktober 2009, S. 24, (Volltext)
- Tracy L. Kivella, Daniel Schmitt: Independent evolution of knuckle-walking in African apes shows that humans did not evolve from a knuckle-walking ancestor. In: PNAS. Band 106, Nr. 34, 2009, S. 14241–14246, doi:10.1073/pnas.0901280106.
Bipedal humans came down from the trees, not up from the ground. Auf: eurekalert.org vom 10. August 2009. - Madelaine Böhme et al: A new Miocene ape and locomotion in the ancestor of great apes and humans. In: Nature. Band 575, 2019, S. 489–493, doi:10.1038/s41586-019-1731-0.
- Rhianna C. Drummond-Clarke et al.: Wild chimpanzee behavior suggests that a savanna-mosaic habitat did not support the emergence of hominin terrestrial bipedalism. In: Science Advances. Band 8, Nr. 50, 2022, doi:10.1126/sciadv.add9752.
Early humans may have first walked upright in the trees. Auf: eurekalert.org vom 14. Dezember 2022. - Kevin D. Hunt: The evolution of human bipedality: ecology and functional morphology. In: Journal of Human Evolution. Band 26, Nr. 3, 1994, S. 183–202, doi:10.1006/jhev.1994.1011.
Kevin D. Hunt: The postural feeding hypothesis: an ecological model for the evolution of bipedalism. In: South African Journal of Science. Band 92, 1996, S. 77–90. - C. Owen Lovejoy: Reexamining Human Origins in Light of Ardipithecus ramidus. In: Science. Band 326, 2009, S. 74, 74e1–74e8, doi:10.1126/science.1175834.
- Giday WoldeGabriel et al.: The Geological, Isotopic, Botanical, Invertebrate, and Lower Vertebrate Surroundings of Ardipithecus ramidus. In: Science. Band 326, 2009, S. 65, 65e1–65e5, doi:10.1126/science.1175817.
- Graeme D. Ruxton, David M. Wilkinson: Avoidance of overheating and selection for both hair loss and bipedality in hominins. In: PNAS. Band 108, Nr. 52, 2011, S. 20965–20969, doi:10.1073/pnas.1113915108.
- Peter E. Wheeler: The evolution of bipedality and loss of functional body hair in hominids. In: Journal of Human Evolution. Band 13, Nr. 1, 1984, S. 91–98, doi:10.1016/S0047-2484(84)80079-2.
The Naked and the Bipedal. Early hominids may have stood up and gotten naked as a way to cope with heat stress on the sere African savanna. Tim Folger auf discovermagazine.com vom 1. November 1993. - Benjamin H. Passey et al.: High-temperature environments of human evolution in East Africa based on bond ordering in paleosol carbonates. In: PNAS. Band 107, Nr. 25, 2011, S. 11245–11249, doi:10.1073/pnas.1001824107.
East-African human ancestors lived in hot environments, says Caltech-led team. Auf: eurekalert.org vom 8. Juni 2010. Hier heißt es als wörtliches Zitat des Co-Autors der PNAS-Studie, John Eiler (Robert P. Sharp Professor of Geology und professor of geochemistry am California Institute of Technology): „For example, by standing upright, we intercept less direct sunlight than if we were on all fours, and in hot, open environments, the ground and near-surface air can be appreciably hotter than the air a few feet above the ground. So, by standing upright, we are avoiding a high-temperature environment.“ - Graeme D. Ruxton und David M. Wilkinson: Thermoregulation and endurance running in extinct hominins: Wheeler’s models revisited. In: Journal of Human Evolution. Band 61, Nr. 2, 2011, S. 169–175, doi:10.1016/j.jhevol.2011.02.012.
- C. Owen Lovejoy: The Origin of Man. In: Science. Band 211, 1981, S. 341–350, doi:10.1126/science.211.4480.341.
- nachzulesen in Science, Band 217, S. 295–304; die kritischen Stellungnahmen stammten von Glynn Isaac, Diahan Harley, James W. Wood, Linda D. Wolfe, J. Patrick Gray, John G. Robinson, Leslie S. Lieberman, Elizbeth H. Peters, Rebecca L. Cann und Allan C. Wilson.
- Belegt ist dies allerdings erst für Homo erectus: Curtis W. Marean et al.: Early human use of marine resources and pigment in South Africa during the Middle Pleistocene. In: Nature. Band 449, 2007, S. 905–908; doi:10.1038/nature06204.
- Carsten Niemitz: Das Geheimnis des aufrechten Gangs. Unsere Evolution verlief anders. C. H. Beck, München, 2004, ISBN 3-406-51606-8.
- Carsten Niemitz: The evolution of the upright posture and gait — a review and a new synthesis. In: Naturwissenschaften. Band 97, Nr. 3, S. 241–263 doi:10.1007/s00114-009-0637-3.
- Algis Kuliukas: Wading for Food: The Driving Force of the Evolution of Bipedalism? In: Nutrition and Health. Band 16, Nr. 4, 2002, S. 267–289, Volltext (Memento vom 8. Dezember 2015 im Internet Archive)
- Ronald J. Clarke, Phillip Tobias: Sterkfontein member 2 foot bones of the oldest South African hominid. In: Science. Band 269, 1995, S. 521; doi:10.1126/science.7624772.
- Katherine K. Whitcome, Liza J. Shapiro, Daniel E. Lieberman: Fetal load and the evolution of lumbar lordosis in bipedal hominins. In: Nature. Band 450, 2007, S. 1075–1078, doi:10.1038/nature06342.
- 2 Abbildungen: anthro.palomar.edu und goatstar.org (Memento vom 26. Dezember 2010 im Internet Archive) Vergleich des Beckens von Schimpanse, Australopithecus und Mensch.
- Barbara Fischer et al.: Sex differences in the pelvis did not evolve de novo in modern humans. In: Nature Ecology & Evolution. Online-Veröffentlichung vom 25. März 2021, doi:10.1038/s41559-021-01425-z.
Weibliches Becken schon lange weiter. Auf: science.orf.at vom 26. März 2021. - Scott W. Simpson et al: A Female Homo erectus Pelvis from Gona, Ethiopia. In: Science. Band 322, Nr. 5904, 2008, S. 1089–1092, doi:10.1126/science.1163592.
- Enge Becken, große Köpfe und die schwierige Geburt beim Menschen. Auf: idw-online.de vom 21. April 2015.
- Nicole Grunstra et al.: There is an obstetrical dilemma: Misconceptions about the evolution of human childbirth and pelvic form. In: American Journal of Biological Anthropology. Online-Vorabveröffentlichung vom 23. Juni 2023, doi:10.1002/ajpa.24802.
- Holly M. Dunsworth et al.: Metabolic hypothesis for human altriciality. In: PNAS. Band 109, Nr. 38, 2012, S. 15212–15216, doi:10.1073/pnas.1205282109.
- Michael H. Morgan, David R. Carrier: Protective buttressing of the human fist and the evolution of hominin hands. In: Journal of Experimental Biology. Band 216, 2013, S. 236–244, doi:10.1242/jeb.075713.
Fine hands, fists of fury. Our hands evolved for punching, not just dexterity. Auf: eurekalert.org vom 19. Dezember 2012. - Matthew M. Skinner et al.: Human-like hand use in Australopithecus africanus. In: Science. Band 347, Nr. 6220, 2015, S. 395–399, doi:10.1126/science.1261735.
Australopithecus africanus – Kräftige Hände zum präzisen Zupacken. Auf: idw-online vom 22. Januar 2015. - Fotios Alexandros Karakostis et al.: Biomechanics of the human thumb and the evolution of dexterity. In: Current Biology. Online-Veröffentlichung (open access) vom 28. Januar 2021, doi:10.1016/j.cub.2020.12.041.
Beweglicher Daumen ebnete den Weg zur menschlichen Kultur. Auf: idw-online.de vom 28. Januar 2021. - Erin Marie Williams-Hatala et al.: The manual pressures of stone tool behaviors and their implications for the evolution of the human hand. In: Journal of Human Evolution. Band 119, 2018, S. 14–26, doi:10.1016/j.jhevol.2018.02.008.
Eating bone marrow played a key role in the evolution of the human hand. Auf: eurekalert.org vom 11. Juli 2018. - Tomoko Sakai et al.: Fetal brain development in chimpanzees versus humans. In: Current Biology. Band 22, Nr. 18, 2012, S. R791–R792, doi:10.1016/j.cub.2012.06.062.
Human brains outpace chimp brains in the womb. Auf: eurekalert.org vom 24. September 2012.
Schimpansenhirne hören früher auf zu wachsen. (Memento vom 12. Oktober 2012 im Internet Archive) Auf: new-scientist.de vom 8. Oktober 2012 (mit Video). - Winfried Henke, Hartmut Rothe: Menschwerdung. Fischer. Taschenbuch Verlag, Frankfurt am Main 2003, ISBN 3-596-15554-1, S. 9 (book2look.com [PDF] Leseprobe).
- Simon Neubauer, Jean-Jacques Hublin und Philipp Gunz: The evolution of modern human brain shape. In: Science Advances. Band 4, Nr. 1, 2018, eaao5961, doi:10.1126/sciadv.aao5961.
Langsame und späte Evolution des menschlichen Gehirns. Auf: mpg.de vom 24. Januar 2018. - Steve Jones et al: The Cambridge Encyclopedia of Human Evolution. Cambridge University Press, 1992, S. 115.
- Axel Kleidon: Climatic constraints on maximum levels of human metabolic activity and their relation to human evolution and global change. In: Climatic Change. Band 95, Nr. 3–4, 2009, S. 405–431, doi:10.1007/s10584-008-9537-3.
- Roger S. Seymour et al: Fossil skulls reveal that blood flow rate to the brain increased faster than brain volume during human evolution. In: Royal Society Open Science. Online-Publikation vom 1. August 2016, doi:10.1098/rsos.160305.
Roger S. Seymour et al.: Correction to ‘Fossil skulls reveal that blood flow rate to the brain increased faster than brain volume during human evolution’. In: Royal Society Open Science. Online-Publikation vom 30. August 2017, doi:10.1098/rsos.170846. - Leslie C. Aiello, Peter Wheeler: The Expensive-Tissue Hypothesis: The Brain and the Digestive System in Human and Primate Evolution. In: Current Anthropology Band 36, Nr. 2, 1995, S. 199–221, doi:10.1086/204350, Volltext (PDF) (Memento vom 26. Januar 2012 im Internet Archive); vergl. Expensive Tissue Hypothesis.
Ana Navarrete, Carel P. van Schaik und Karin Isler: Energetics and the evolution of human brain size. In: Nature. Band 480, 2011, S. 91–93, doi:10.1038/nature10629. - David W. Schwartzman und George Middendorf: Biospheric cooling and the emergence of intelligence. In: G. Lemarchand, K. Meech (Hrsg.): A new era in bioastronomy. Band 213, 2000, ASP Conference Series, S. 425–429.
- David Schwartzman, George Middendorf, Miranda Armour-Chelu: Was climate the prime releaser for encephalization? An editorial comment. In: Climate Change. Band 95, Nr. 3–4, 2009, S. 439–447, doi:10.1007/s10584-009-9603-5.
- Drew H. Bailey und David C. Geary: Hominid Brain Evolution. Testing Climatic, Ecological, and Social Competition Models. In: Human Nature. Band 20, Nr. 1, 2009, S. 67–79, doi:10.1007/s12110-008-9054-0.
- Ronald M. Nowak: Walker’s mammals of the world. 6. Auflage. Johns Hopkins University Press, Baltimore 1999, S. 613.
Wolfgang Maier: Primates, Primaten, Herrentiere. In: Wilfried Westheide, Reinhard Rieger (Hrsg.): Spezielle Zoologie. Teil 2. Wirbel- oder Schädeltiere. Spektrum Akademischer Verlag, Heidelberg/Berlin 2004, S. 573. - Gehirnvolumen. Auf: spektrum.de, zuletzt abgerufen am 21. März 2022.
- Matthew M. Skinner und Bernard Wood: The evolution of modern human life history – a paleontological perspective. In: Kristen Hawkes und Richard R. Paine (Hrsg.): The Evolution of Modern Human Life History. School of American Research Press, Santa Fe 2006, ISBN 1-930618-72-7, S. 351. – Ausgewiesen ist jeweils das arithmetische Mittel und in Klammern das 95 %-Konfidenzintervall.
- Gen Suwa et al: The Ardipithecus ramidus Skull and Its Implications for Hominid Origins. In: Science. Band 326, 2009, S. 68, 68e1–68e7, doi:10.1126/science.1175825.
- Gary J. Sawyer, Viktor Deak: Der lange Weg zum Menschen. Lebensbilder aus 7 Millionen Jahren Evolution. Spektrum Akademischer Verlag, Heidelberg, 2008, S. 79.
- Friedemann Schrenk: Die Frühzeit des Menschen. Der Weg zum Homo sapiens, C. H. Beck, 1997, S. 70.
- Dean Falk et al.: Brain shape in human microcephalics and Homo floresiensis. In: PNAS. Band 104, Nr. 7, 2007, S. 2513–2518, doi:10.1073/pnas.0609185104.
- Hansell H. Stedman et al.: Myosin gene mutation correlates with anatomical changes in the human lineage. In: Nature. Band 428, 2004, S. 415–418, doi:10.1038/nature02358.
- Marcia S. Ponce de León, Thibault Bienvenu, Assaf Marom et al.: The primitive brain of early Homo. In: Science. Band 372, Nr. 6538, 2021, S. 165–171, doi:10.1126/science.aaz0032.
Modernes Gehirn des Menschen entstand vor rund 1,7 Millionen Jahren in Afrika. Auf: idw-online.de vom 8. April 2021.
Our earliest ancestors weren’t as brainy as we thought, fossil skulls suggest. Auf: sciencemag.org vom 8. April 2021. - David Robson: A brief history of the brain. In: New Scientist. Nr. 2831, 24. September 2011, S. 44.
- Dean Falk et al: Metopic suture of Taung (Australopithecus africanus) and its implications for hominin brain evolution. In: PNAS. Band 109, Nr. 22, 2012, S. 8467–8470, doi:10.1073/pnas.1119752109, Volltext.
- Markus Bastir et al.: Evolution of the base of the brain in highly encephalized human species. In: Nature Communications. Band 2, Artikel-Nr. 588, 2011, doi:10.1038/ncomms1593.
- Emiliano Bruner: Scheitelpunkt der Menschwerdung. In: Gehirn & Geist. Nr. 10, 2016, S. 44.
- Chet C. Sherwood et al.: Aging of the cerebral cortex differs between humans and chimpanzees. In: PNAS. Band 108, Nr. 32, 2011, S. 13029–13034, doi:10.1073/pnas.1016709108.
- Rodrigo S. Lacruz, Chris B. Stringer, William H. Kimbel, Bernard Wood, Katerina Harvati, Paul O’Higgins, Timothy G. Bromage und Juan-Luis Arsuaga: The evolutionary history of the human face. Review Article in: Nature Ecology & Evolution. Band 3, 2019, S. 726–736, doi:10.1038/s41559-019-0865-7.
Need for social skills helped shape modern human face. Auf: eurekalert.org vom 15. April 2019. - Bernard Wood, Terry Harrison: The evolutionary context of the first hominins. In: Nature. Band 470, 2011, S. 348, doi:10.1038/nature09709.
- Katherine D. Zink und Daniel E. Lieberman: Impact of meat and Lower Palaeolithic food processing techniques on chewing in humans. In: Nature. Band 531, 2016, S. 500–503, doi:10.1038/nature16990.
- Charles Darwin: The Descent of Man, and Selection in Relation to Sex. London, John Murray, 1871, Band 1, S. 199: „In each great region of the world the living mammals are closely related to the extinct species of the same region. It is therefore probable that Africa was formerly inhabited by extinct apes closely allied to the gorilla and chimpanzee; and as these two species are now man's nearest allies, it is somewhat more probable that our early progenitors lived on the African continent than elsewhere.“
- Charles Darwin: Die Abstammung des Menschen und die geschlechtliche Zuchtwahl. 3. Auflage. gänzlich umgearbeitete Auflage, aus dem Englischen übersetzt von J. Victor Carus. In: Ch. Darwin's gesammelte Werke, Bd. 5, E. Schweizerbart’sche Verlagshandlung (E. Koch), Stuttgart 1875, S. 68; Digitalisat.
- Gen Suwa et al: Paleobiological Implications of the Ardipithecus ramidus Dentition. In: Science. Band 326, 2009, S. 69, 94–99, doi:10.1126/science.1175824.
- Gen Suwa et al.: Paleobiological Implications of the Ardipithecus ramidus Dentition. In: Science. Band 326, Nr. 5949, 2009, S. 69, doi:10.1126/science.1175824.
- Winfried Henke, Hartmut Rothe: Stammesgeschichte des Menschen. Springer Verlag, Berlin 1999, S. 33–34.
- Friedemann Schrenk in: Spektrum der Wissenschaft. Nr. 9/2010, S. 69. – Für einen Homo erectus aus Indonesien sowie für Homo rudolfensis ist der gleichen Quelle zufolge belegt, dass ihre Vorderbackenzähne noch zwei Zahnwurzeln hatten.
- Christopher Dean: Developmental sequences and rates of growth in tooth length in hominoids. In: R. J. Radlanski, H. Renz (Hrsg.): Structure, Function and Evolution of Teeth. Proceedings of the 10th International Symposium on Dental Morphology. M Marketing Services Brünne GbR, Berlin 1995, S. 308–313.
- Gabriele A. Macho und Bernard Wood: The role of time and timing in hominid dental evolution. In: Evolutionary Anthropology. Band 4, Nr. 1, 1995, S. 17–31, doi:10.1002/evan.1360040105, Volltext (PDF; 2,5 MB) (Memento vom 2. Februar 2014 im Internet Archive)
- Alan Mann, Michelle Lampl und Janet Monge: Patterns of ontogeny in human evolution: Evidence from dental development. In: American Journal of Physical Anthropology. Band 33, Supplement S11 (= Yearbook of Physical Anthropology). 1990, S. 111–150, doi:10.1002/ajpa.1330330507.
- Glenn C. Conroy und Michael W. Vannier: Dental development in South African australopithecines. Part I: Problems of pattern and chronology. In: American Journal of Physical Anthropology. Band 86, Nr. 2, 1991, S. 121–136, doi:10.1002/ajpa.1330860204.
- Noreen von Cramon-Taubadel: Global human mandibular variation reflects differences in agricultural and hunter-gatherer subsistence strategies. In: PNAS. Band 108, Nr. 49, 2011, S. 19546–19551, doi:10.1073/pnas.1113050108.
- H.V. Weems und T.R. Fasulo: Human Lice: Body Louse, Pediculus humanus humanus Linnaeus and Head Louse, Pediculus humanus capitis De Geer (Insecta: Phthiraptera (=Anoplura): Pediculidae). Dokument EENY-104 des US-Department of Entomology and Nematology, Stand: März 2017, Volltext (PDF; 510 kB).
- D. L. Reed, J. E. Light, J. M. Allen, J. J. Kirchman: Pair of lice lost or parasites regained: the evolutionary history of anthropoid primate lice. In: BMC biology. Band 5, Nr. 7, 2007, doi:10.1186/1741-7007-5-7. PMID 17343749, PMC 1828715 (freier Volltext).
- Ralf Kittler, Manfred Kayser und Mark Stoneking: Molecular Evolution of Pediculus humanus and the Origin of Clothing. In: Current Biology. Band 13, Nr. 16, 2003, S. 1414–1417, doi:10.1016/S0960-9822(03)00507-4.
- Melissa A. Toups et al: Origin of Clothing Lice Indicates Early Clothing Use by Anatomically Modern Humans in Africa. In: Molecular Biology and Evolution. Band 28, Nr. 1, 2011, S. 29–32, doi:10.1093/molbev/msq234.
- Alan. R. Rogers et al.: Genetic Variation at the MC1R Locus and the Time since Loss of Human Body Hair. In: Current Anthropology. Band 45, Nr. 1, 2004, S. 105–108, doi:10.1086/381006.
- Thomas Junker: Die Evolution des Menschen. C. H. Beck, München 2008, S. 89.
- Nina G. Jablonski: Warum Menschen nackt sind. In: Spektrum der Wissenschaft. 10/2010, S. 60–67.
- Mark Pagel und Walter Bodmer: A naked ape would have fewer parasites. In: Proceedings of the Royal Society (London) B. Band 270, Nr. Suppl 1, 2003, Seite S117–S119, doi:10.1098/rsbl.2003.0041.
- Herman Pontzer et al.: Evolution of water conservation in humans. In: Current Biology.Band 31, Nr. 8, S. 1804–1810.e5, 2021, doi:10.1016/j.cub.2021.02.045.
Humans evolved to be the water-saving ape. Auf: eurekalert.org vom 5. März 2021. - Tina Lasisi, James W. Smallcombe, W. Larry Kenney et al.: Human scalp hair as a thermoregulatory adaptation. In: PNAS. Band 120, Nr. 24, 2023, e2301760120, doi:10.1073/pnas.2301760120
- Yana G. Kamberov et al.: Modeling Recent Human Evolution in Mice by Expression of a Selected EDAR Variant. In: Cell. Band 152, Nr. 4, 2013, S. 691–702, doi:10.1016/j.cell.2013.01.016.
- Friedemann Schrenk, Stephanie Müller: Die 101 wichtigsten Fragen: Urzeit. C. H. Beck, München 2006, S. 49.
- Inge Kronberg: Geografische Verteilung der Hautfarbe. In: Biologie in unserer Zeit. 29. März 2006, S. 76–77.
- Flüchtiger Teint. In: Geo. Nr. 10, 2009, S. 22.
- wörtlich: „Skin coloration in humans is adaptive and labile. Skin pigmentation levels have changed more than once in human evolution. Because of this, skin coloration is of no value in determining phylogenetic relationships among modern human groups.“ Zitiert aus: Nina G. Jablonski, George Chaplin: The evolution of human skin coloration. In: Journal of Human Evolution. Band 39, 2000, S. 57–106 (hier: S. 57), doi:10.1006/jhev.2000.0403, Volltext (PDF; 3,2 MB). (Memento vom 6. September 2015 im Internet Archive)
- Prof. Dieter Böning: Sexuelle Selektion beim Menschen – ein Tabuthema? In: Spektrum der Wissenschaft. Heft 12/2010, S. 7.
- Richard Leakey, The origin of humankind. S. 20.
- Cade McCall und Tania Singer: The animal and human neuroendocrinology of social cognition, motivation and behavior. In: Nature Neuroscience. Band 15, 2012, S. 681–688, doi:10.1038/nn.3084.
- Mary Ann Raghanti et al.: A neurochemical hypothesis for the origin of hominids. In: PNAS. Band 115, Nr. 6, E1108-E1116O, 2018, doi:10.1073/pnas.1719666115.
Dopamine may have given humans our social edge over other apes. Auf: sciencemag.org vom 22. Januar 2018. - Jeremy DeSilva, Julie Lesnik: Chimpanzee neonatal brain size: Implications for brain growth in Homo erectus. In: Journal of Human Evolution. Band 51, Nr. 2, 2006, S. 207–212, doi:10.1016/j.jhevol.2006.05.006.
- Hélène Coqueugniot et al: Early brain growth in Homo erectus and implications for cognitive ability. In: Nature. Band 431, 2004, S. 299–302, doi:10.1038/nature02852, Volltext.
- Ann Gibbons: The Birth of Childhood. In: Science. Band 322, Nr. 5904, 2008, S. 1040–1043, doi:10.1126/science.322.5904.1040; Abbildung aus Science: Vergleich der Beckenform von Australopithecus, Homo erectus und Mensch.
- Tanya M. Smith et al.: Earliest evidence of modern human life history in North African early Homo sapiens. In: PNAS. Band 104, Nr. 15, 2007, S. 6128–6133, doi:10.1073/pnas.0700747104.
- Pierre Frémondière et al.: Dynamic finite-element simulations reveal early origin of complex human birth pattern. In: Communications Biology. Band 5, Artikel-Nr. 377, 2022, doi:10.1038/s42003-022-03321-z.
Schwierige Geburt und kognitive Fähigkeiten des Menschen sind Folge des aufrechten Ganges. Auf: idw-online.de vom 10. Mai 2022. - Timothy G. Bromage und M. Christopher Dean: Re-evaluation of the age at death of immature fossil hominids. In: Nature. Band 317, 1985, S. 525–527, doi:10.1038/317525a0.
- Tanya M. Smith et al.: Dental evidence for ontogenetic differences between modern humans and Neanderthals. In: PNAS. Band 107, Nr. 49, 2010, S. 20923–20928, doi:10.1073/pnas.1010906107.
- durchschnittliche Lebenserwartung in den Industrieländern.
- Winfried Henke, Hartmut Rothe: Stammesgeschichte des Menschen. Springer Verlag, Berlin 1999, S. 39.
- Caleb E. Finch: Evolution of the human lifespan and diseases of aging: Roles of infection, inflammation, and nutrition. In: PNAS. Band 107, Supplement 1, 2010, S. 1718–1724, doi:10.1073/pnas.0909606106.
Why we outlive our ape ancestors. Auf: eurekalert.org vom 2. Dezember 2009. - Craig Packer et al.: Reproductive cessation in female mammals. In: Nature. Band 392, 1998, S. 807–811, doi:10.1038/33910.
- Alison Motlok: Bye-bye babies. In: New Scientist. 13. Dezember 2008, S. 41–43.
- Winfried Henke, Hartmut Rothe: Stammesgeschichte des Menschen. Springer Verlag, Berlin 1999, S. 191.
- Mirkka Lahdenperä et al.: Fitness benefits of prolonged post-reproductive lifespan in women. In: Nature. Band 428, 2004, S. 178–181, doi:10.1038/nature02367.
- Erwin J. Haeberle: Die Sexualität des Menschen. Handbuch und Atlas. 2., erweiterte Auflage. Verlag Walter de Gruyter, Berlin/ New York 1985, ISBN 3-11-010694-9, S. 140.
- Larry J. Young: Being Human: Love: Neuroscience reveals all. In: Nature. Band 457, 2009, S. 148, doi:10.1038/457148a
- C. Owen Lovejoy: The Origin of Man. In: Science. Band 211, 1981, S. 341–350, doi:10.1126/science.211.4480.341.
- A. F. Dixson: Baculum length and copulatory behavior in primates. In: American Journal of Primatology. Band 13, Nr. 1, 1987, S. 51–60, doi:10.1002/ajp.1350130107.
- Damian Labuda et al.: Female-to-Male Breeding Ratio in Modern Humans – an Analysis Based on Historical Recombinations. In: The American Journal of Human Genetics. Band 86, Nr. 3, 2010, S. 353–363, doi:10.1016/j.ajhg.2010.01.029.
- Asif A. Ghazanfar et al.: Cineradiography of Monkey Lip-Smacking Reveals Putative Precursors of Speech Dynamics. In: Current Biology. Band 22, Nr. 13, 2012, S. 1176–1182, doi:10.1016/j.cub.2012.04.055
Current Biology: Lippenschmatzen von Affen bietet Einblicke in die Evolution der Sprache. Auf: idw-online vom 31. Mai 2012. - Winfried Henke, Hartmut Rothe: Stammesgeschichte des Menschen. Springer Verlag, Berlin 1999, S. 80–81.
- W. Tecumseh Fitch: The evolution of language. In: New Scientist. 4. Dezember 2010, Beiheftung Instant Expert 6, S. i–viii.
- Sprach-Gen: Warum Menschen sprechen können. (Memento vom 27. November 2014 im Internet Archive). Im Original publiziert auf aerzteblatt.de vom 12. November 2009.
Sprachgen des Menschen ist einzigartig. Auf: berliner-zeitung.de vom 15. August 2002. - Wolfgang Enard et al.: Molecular evolution of FOXP2, a gene involved in speech and language. In: Nature. Band 418, 2002, S. 869–872, doi:10.1038/nature01025.
Eine Mutation trennt Mensch und Affe. Auf: spiegel.de vom 15. August 2002. - Roger Fouts, Stephen Tukel Mills: Unsere nächsten Verwandten. Von Schimpansen lernen, was es heißt, ein Mensch zu sein. Limes Verlag, München 1998, ISBN 3-8090-3013-9 (2002 auch als Taschenbuch bei Droemer Knaur erschienen, ISBN 3-426-77420-8).
- Grammatik aus dem Nichts. Über taubstumme Kinder und Kreolsprachen, S. 257 In: Dieter E. Zimmer: Experimente des Lebens. Haffmans Verlag., Zürich 1989, ISBN 3-251-00139-6.
- Steven Pinker: Der Sprachinstinkt. Kindler, München 1996, ISBN 3-463-40267-X.
- Zeit Schimp Sprechen. Über Sprachversuche mit Menschenaffen. In: Dieter E. Zimmer: Experimente des Lebens. Haffmans Verlag., Zürich 1989, ISBN 3-251-00139-6.
- „Increasing evidence indicates that vocal signals can have a similar function to grooming in mediating social interactions and relationships.“ Nathalie C. Greeno, Stuart Semple: Sex differences in vocal communication among adult rhesus macaques. In: Evolution and Human Behavior. Band 30, Nr. 2, 2009, S. 141–145, doi:10.1016/j.evolhumbehav.2008.09.002.
- Eörs Szathmáry, Szabolcs Számadó: Language: a social history of words. In: Nature. Band 456, 2008, S. 40–41, doi:10.1038/456040a.
- Samuel Bowles: Conflict: Altruism's midwife. In: Nature. Band 456, 2008, S. 326–327, doi:10.1038/456326a, Volltext (PDF; 144 kB).
Martin A. Nowak: Generosity: A winner's advice. In: Nature. Band 456, 2008, S. 579, doi:10.1038/456579a. - Otto König: Kultur und Verhaltensforschung - Einführung in die Kulturethologie. DTV-Verlag 1970, ISBN 3-423-00614-5.
- Richard Dawkins: Meme, die neuen Replikatoren. In: Das egoistische Gen. (original: The Selfish Gene, Oxford University Press, 1976). Jubiläumsausgabe 2007, ISBN 978-3-8274-1839-5, S. 316–334.
- Susan Blackmore: Die Macht der Meme. Spektrum Akademischer Verlag, Heidelberg/ Berlin 2000, ISBN 3-8274-1601-9.
- Kate Douglas: Culture club. In: New Scientist. 20. November 2010, S. 38–41.
- Andrew Whiten, Jane Goodall et al: Cultures in chimpanzees. In: Nature. Band 399, 1999, S. 682–685, doi:10.1038/21415.
- Luke Rendell, Hal Whitehead: Culture in whales and dolphins. In: Behavioral and Brain Sciences. Band 24, 2001, S. 309–324, doi:10.1017/S0140525X0100396X.
- Carel P. van Schaik et al.: Orangutan Cultures and the Evolution of Material Culture. In: Science. Band 299, Nr. 5603, 2003, S. 102–105, doi:10.1126/science.1078004.
- Susan Perry et al.: Social Conventions in Wild White‐faced Capuchin Monkeys: Evidence for Traditions in a Neotropical Primate. In: Current Anthropology. Band 44, Nr. 2, 2003, S. 241–268.
- Doron M. Behar et al.: The Dawn of Human Matrilineal Diversity. In: American Journal of Human Genetics. Band 82, 2008, S. 1130–1140, doi:10.1016/j.ajhg.2008.04.002.
- Quentin D. Atkinson: Phonemic Diversity Supports a Serial Founder Effect Model of Language Expansion from Africa. In: Science. Band 332, Nr. 6027, 2011, S. 346–349, doi:10.1126/science.1199295.
- Caleb Everett et al.: Climate, vocal folds, and tonal languages: Connecting the physiological and geographic dots. In: PNAS. Band 112, Nr. 5, 2015, S. 1322–1327, doi:10.1073/pnas.1417413112.
- Murray Gell-Mann, Merritt Ruhlen: The origin and evolution of word order. In: PNAS. Band 108, Nr. 42, 2011, S. 17290–17295, doi:10.1073/pnas.1113716108.
- ‚I the dog see‘, our ancestors said. In: New Scientist. 15. Oktober 2011, S. 19.
- The writing on the cave wall. Auf: newscientist.com vom 17. Februar 2010. Unter dem Titel Messages from the stone age auch erschienen in New Scientist, Nr. 2748 vom 20. Februar 2010, S. 32–34.
Archäologie: Die Schrift an der Wand. Die Höhlenmalereien bestehen nicht nur aus Darstellungen, sondern vielleicht auch aus Zeichen. Auf: diepresse.com vom 19. Februar 2010. - Sherwood L. Washburn: Tools and human evolution. In: Scientific American. Band 203, 1960, S. 63–75.
- Jane Goodall: Tool-Using and Aimed Throwing in a Community of Free-Living Chimpanzees. In: Nature. Band 201, 1964, S. 1264–1266, doi:10.1038/2011264a0.
- William C. McGrew: Chimpanzee Technology. In: Science. Band 328, Nr. 5978, 2010, S. 579–580, doi:10.1126/science.1187921.
- Michael Haslam et al.: Primate archaeology. In: Nature. Band 460, 2009, S. 339–344, doi:10.1038/nature08188.
- Thomas W. Plummer et al.: Expanded geographic distribution and dietary strategies of the earliest Oldowan hominins and Paranthropus. In: Science. Band 379, Nr. 6632, 2023, S. 561–566,
- S. Semaw, P. Renne, J. W. K. Harris, C. S. Feibel, R. L. Bernor, N. Fesseha and K. Mowbray: 2.5-million-year-old stone tools from Gona, Ethiopia. In: Nature. Band 385, 1997, S. 333–336 doi:10.1038/385333a0.
- Sileshi Semaw: The World’s Oldest Stone Artefacts from Gona, Ethiopia: Their Implications for Understanding Stone Technology and Patterns of Human Evolution Between 2.6–1.5 Million Years Ago. In: Journal of Archaeological Science. Band 27, 2000, S. 1197–1214 doi:10.1006/jasc.1999.0592.
- Shannon P. McPherron et al.: Evidence for stone-tool-assisted consumption of animal tissues before 3.39 million years ago at Dikika. In: Nature. Band 466, 2010, S. 857–860, doi:10.1038/nature09248.
- Manuel Domínguez-Rodrigo et al.: Configurational approach to identifying the earliest hominin butchers. In: PNAS. Band 107, Nr. 49, 2010, S. 20929–20934, doi:10.1073/pnas.1013711107.
- Jayne Wilkins et al.: Evidence for Early Hafted Hunting Technology. In: Science. Band 338, Nr. 6109, 2012, S. 942–946, doi:10.1126/science.1227608.
Archaeologists identify spear tips used in hunting a half-million years ago. Auf: eurekalert.org vom 15. November 2012, mit Abbildung. - David R. Braun et al: Early hominin diet included diverse terrestrial and aquatic animals 1.95 Ma in East Turkana, Kenya. In: PNAS. Band 107, Nr. 22, 2010, S. 10002–10007, doi:10.1073/pnas.1002181107.
- Anders Högberg und Lars Larsson: Lithic technology and behavioural modernity: New results from the Still Bay site, Hollow Rock Shelter, Western Cape Province, South Africa. In: Journal of Human Evolution. Band 61, Nr. 2, 2011, S. 133–155, doi:10.1016/j.jhevol.2011.02.006.
Cutting edge training developed the human brain 80,000 years ago. Auf: eurektalert.com vom 21. Juni 2011. - Aldo Faisal et al.: The Manipulative Complexity of Lower Paleolithic Stone Toolmaking. In: PLoS ONE. Band 5, Nr. 11: e13718, 2010, doi:10.1371/journal.pone.0013718.
- Kyle S. Brown et al.: Fire As an Engineering Tool of Early Modern Humans. In: Science. Band 325, Nr. 5942, 2009, S. 859–862, doi:10.1126/science.1175028.
Early modern humans use fire to engineer tools from stone. Auf: eurekalert.org vom 13. August 2009. - Pat Shipman: The Animal Connection and Human Evolution. In: Current Anthropology. Band 51, Nr. 4, 2010, S. 519–538, Kurzfassung.
New hypothesis for human evolution and human nature. Auf: eurekalert.org vom 20. Juli 2010. - Eliso Kvavadze et al.: 30,000-Year-Old Wild Flax Fibers. In: Science. Band 325, 2009, S. 1359, doi:10.1126/science.1175404.
Archaeologists discover oldest-known fiber materials used by early humans. Auf: eurekalert.org vom 10. September 2009. - James M. Adovasio et al.: Perishable Industries from Dolni Vestonice I: New Insights into the Nature and Origin of the Gravettian. In: Archaeology, Ethnology and Anthropology of Eurasia. Band 2, Nr. 6, S. 48–65.
- Luc Doyon et al.: A 39,600-year-old leather punch board from Canyars, Gavà, Spain. In: Science Advances. Band 9, Nr. 15, 2023, doi:10.1126/sciadv.adg0834.
Merkwürdiger Knochen half vielleicht bei der Lederverarbeitung. Auf: spektrum.de vom 12. April 2023. - Hansjürgen Müller-Beck: Die Eiszeiten. Naturgeschichte und Menschheitsgeschichte. C. H. Beck, München 2005, ISBN 3-406-50863-4, S. 96.
- Ken Sayers, C. Owen Lovejoy: Blood, Bulbs, and Bunodonts: On Evolutionary Ecology and the Diets of Ardipithecus, Australopithecus, and Early Homo. In: The Quarterly Review of Biology. Band 89, Nr. 4, 2014, S. 319–357, doi:10.1086/678568.
What was the 'Paleo diet'? There was far more than one, study suggests. Auf: eurekalert.org vom 16. Dezember 2014. - Peter S. Ungar, Matt Sponheimer: The Diets of Early Hominins. In: Science. Band 334, Nr. 6053, 2011, S. 190–193, doi:10.1126/science.1207701.
- Chris Organ et al.: Phylogenetic rate shifts in feeding time during the evolution of Homo. In: PNAS. Band 108, Nr. 35, 2011, S. 14555–14559, doi:10.1073/pnas.1107806108.
- Gary J. Sawyer, Viktor Deak: Der lange Weg zum Menschen. Lebensbilder aus 7 Millionen Jahren Evolution. Spektrum, Heidelberg 2008, ISBN 978-3-8274-1915-6, S. 36.
- Ann Gibbons: Food for Thought. In: Science. Band 316. Nr. 5831, 2007, S. 1558–1560, doi:10.1126/science.316.5831.1558.
- Felix Warneken und Alexandra G. Rosati: Cognitive capacities for cooking in chimpanzees. In: Proceedings of the Royal Society B. Band 282, Nr. 1809, 2015, doi:10.1098/rspb.2015.0229.
- Naama Goren-Inbar, Nira Alperson, Mordechai E. Kislev, Orit Simchoni, Yoel Melamed, Adi Ben-Nun und Ella Werker: Evidence of Hominin Control of Fire at Gesher Benot Ya`aqov, Israel. In: Science. Band 304, 2004, S. 725–727, doi:10.1126/science.1095443.
- Wil Roebroeks, Paola Villa: On the earliest evidence for habitual use of fire in Europe. In: PNAS. Band 108, Nr. 13, 2011, S. 5209–5214, doi:10.1073/pnas.1018116108.
- Ausführlich erörtert wird der Zusammenhang von Nahrungsbearbeitung durch Erhitzen und Evolution des Homo sapiens in einem Buch von Richard Wrangham: Feuer fangen. Wie uns das Kochen zum Menschen machte – eine neue Theorie der menschlichen Evolution. DVA, München 2009, ISBN 978-3-421-04399-3 (Originaltitel: Catching Fire: How Cooking Made Us Human.)
- Neil Mann: Meat in the human diet: An anthropological perspective. In: Nutrition & Dietetics. Band 64, s4, 2007, S. S102–S107, doi:10.1111/j.1747-0080.2007.00194.x.
- Ann Gibbons: What's for Dinner? Researchers Seek Our Ancestors' Answers. In: Science. Band 326, Nr. 5959, 2009, S. 1478–1479, doi:10.1126/science.326.5959.1478
- Frank Eckhardt: Zurück zu den Wurzeln! Die ursprüngliche Ernährung des Menschen. In: Utz Thimm, Karl-Heinz Wellmann (Hrsg.): In aller Munde. Ernährung heute. Suhrkamp, Frankfurt am Main 2004, ISBN 3-518-45602-4, S. 27–37.
- Ann Gibbons: How the modern body shaped up. In: Science. Band 336, Nr. 6081, 2012, S. 538–539, doi:10.1126/science.336.6081.538-b.
- Christopher S. Henshilwood et al.: Emergence of Modern Human Behavior: Middle Stone Age Engravings from South Africa. In: Science. Band 295, 2002, S. 1278–1280, doi:10.1126/science.1067575. Siehe dazu auch die Abbildung in The Japan Times vom 13. Januar 2002.
- Abdeljalil Bouzouggar et al.: 82,000-year-old shell beads from North Africa and implications for the origins of modern human behavior. In: PNAS. Band 104, Nr. 24, 2007, S. 9964–9969 doi:10.1073/pnas.0703877104.
- Pierre-Jean Texier et al.: A Howiesons Poort tradition of engraving ostrich eggshell containers dated to 60,000 years ago at Diepkloof Rock Shelter, South Africa. In: PNAS. Band 107, Nr. 14, 2010, S. 6180–6185, doi:10.1073/pnas.0913047107.
- David Lordkipanidze, Abesalom Vekua et al: The earliest toothless hominin skull. In: Nature. Band 434, 2005, S. 717–718, doi:10.1038/434717b ISSN 0028-0836
- Alejandro Bonmatí et al.: Middle Pleistocene lower back and pelvis from an aged human individual from the Sima de los Huesos site, Spain. In: PNAS. Band 107, Nr. 43, 2010, S. 18386–18391, doi:10.1073/pnas.1012131107.
- Charles Darwin: Die Abstammung des Menschen und die geschlechtliche Zuchtwahl. Band 1, S. 120. Im Originalwortlaut: „There is no evidence that man was aboriginally endowed with the ennobling belief in the existence of an Omnipotent God.“ Charles Darwin: The Descent of Man, and Selection in Relation to Sex. Band 1, S. 65.
- Charles Darwin: Die Abstammung des Menschen und die geschlechtliche Zuchtwahl. Band 1, S. 121. Im Originalwortlaut: „As soon as the important faculties of the imagination, wonder, and curiosity, together with some power of reasoning, had become partially developed, man would naturally have craved to understand what was passing around him, and have vaguely speculated on his own existence.“ Charles Darwin: The Descent of Man, and Selection in Relation to Sex. Band 1, S. 65.
- Ara Norenzayan, Azim F. Shariff: The Origin and Evolution of Religious Prosociality. In: Science. Band 322, Nr. 5898, 2008, S. 58–62, doi:10.1126/science.1158757.
- Ilkka Pyysiäinen und Marc Hauser: The origins of religion: evolved adaptation or by-product? In: Trends in Cognitive Sciences. Band 14, Nr. 3, 2010, S. 104–109, doi:10.1016/j.tics.2009.12.007.
- Pascal Boyer: Being human: Religion: Bound to believe? In: Nature. Band 455, 2008, S. 1038–1039, doi:10.1038/4551038a.
- Michael Brooks: Natural born believers. In: New Scientist. Band 201, Nr. 2694, 2009, S. 30–33, doi:10.1016/S0262-4079(09)60372-9.
- Elizabeth Culotta: On the Origin of Religion. In: Science. Band 326, Nr. 5954, 2009, S. 784–787, doi:10.1126/science.326 784.
- Michael Balter: On the Origin of Art and Symbolism. In: Science. Band 323, Nr. 5915, 2009, S. 709–711, doi:10.1126/science.323.5915.709.
- Eduardo Palacio-Pérez: Cave art and the theory of art: the origins of the religious interpretation of Palaeolithic Graphics Expression. In: Oxford Journal of Archaeology. Band 29, Nr. 1, 2010, S. 1–14, doi:10.1111/j.1468-0092.2009.00337.x. Eine Zusammenfassung ist zu finden unter Religious beliefs are the basis of the origins of Palaeolithic art. Auf: eurekalert.org vom 26. März 2010.
- Vilayanur S. Ramachandran, Sandra Blakeslee: Die blinde Frau, die sehen kann. Rätselhafte Phänomene unseres Bewusstseins. Rowohlt, Reinbek bei Hamburg 2002, S. 285.

