Anthranilsäure
Anthranilsäure (2-Aminobenzoesäure, o-Aminobenzoesäure) ist eine aromatische, farblose bis blassgelbe, blau fluoreszierende Carbonsäure, die als Zwischenprodukt für Farbstoffe, Pharmazeutika, Kosmetika, fotografische Chemikalien und Feinchemikalien, Schmierstoffadditive und Korrosionsschutzmittel verwendet wird. Sie wurde 1841 von Carl Julius Fritzsche (1808–1871) beim alkalischen Abbau von Indigo entdeckt. Die Salze (Carboxylate) und Ester der Anthranilsäure werden als Anthranilate bezeichnet.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Anthranilsäure | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C7H7NO2 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche, süß-schmeckende Blättchen[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 137,14 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,41 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
Zersetzung ab 200 °C[2] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert |
2,05[3] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex |
1,578 (144 °C)[5] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Neben der Anthranilsäure existieren zwei weitere stellungsisomere Formen: die 3-Aminobenzoesäure (m-Aminobenzoesäure) und die 4-Aminobenzoesäure (p-Aminobenzoesäure).
Gewinnung und Darstellung
Eine technische Herstellung von Anthranilsäure erfolgt durch eine Hofmann-Umlagerung von Phthalimid in Gegenwart von Natriumhydroxid und Natriumhypochlorit.[6]

Bei einem anderen Herstellungsverfahren wird 2-Nitrotoluol einer intramolekularen Redoxreaktion unterworfen.[6]
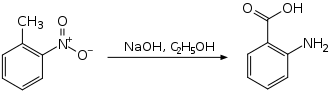
Verwendung
Anthranilsäure dient weiterhin als Ausgangsstoff für die Synthese von Anthranilsäurederivaten, die wegen ihrer Ähnlichkeit zur Salicylsäure als Nichtopioid-Analgetika genutzt werden. Anthranilsäure selbst hat diese Wirkung nicht. Die Ausfuhr des Stoffes aus Deutschland ist teilweise erlaubnispflichtig (siehe Grundstoffüberwachungsgesetz), da sie als Ausgangsstoff für süchtigmachende Substanzen (unter anderem Ketamin und Methaqualon) dienen kann.
Anthranilsäure spielt heute als Ausgangsmaterial für die Synthese der als Riechstoffe bedeutenden Anthranilsäureester und von Indigo sowie von Arzneistoffen und Pflanzenschutzmitteln (Akarizide) eine wichtige Rolle. Anthranilsäure kann zur Bestimmung und zum Nachweis von Ag, Cd, Ce, Co, Cu, Hg, Mn, Ni, Pb, Pd, U und Zn genutzt werden.
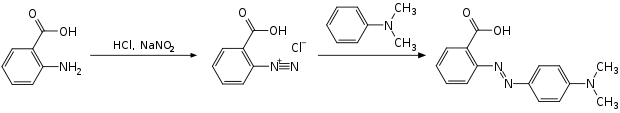
Anthranilsäure ist auch Ausgangsstoff für die Herstellung von Methylrot, eines Azofarbstoffs, dessen Natriumsalz als Säure-Base-Indikator eingesetzt wird. Dazu wird die Aminogruppe der Anthranilsäure mit Natriumnitrit und Salzsäure diazotiert und dann eine Azokupplung mit N,N-Dimethylanilin durchgeführt.[7]
Weblinks
- Synthesis of Heterocycles from Anthranilic acid and its Derivatives (PDF-Datei; 1,08 MB)
- Synthese und Cyclisierung von Anthranilohydroxamsäuren (PDF-Datei; 587 kB)
- Beilstein-Handbuch 14E1
Einzelnachweise
- Eintrag zu Anthranilsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 21. Februar 2014.
- Eintrag zu 2-Aminobenzoesäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- Europäisches Arzneibuch 10.0. Deutscher Apotheker Verlag, 2020, ISBN 978-3-7692-7515-5, S. 707.
- H. A. Frediani: Refractive Index Measurements at and above Melting Point of Solids. In: Industrial & Engineering Chemistry Analytical Edition. Band 14, Nr. 5, 1942, S. 439–441, doi:10.1021/i560105a023.
- S. Hauptmann, J. Graefe, H. Remane: Lehrbuch der Organischen Chemie, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1980.
- Autorenkollektiv: Organikum, 22. Auflage, Wiley-VCH, Weinheim 2004, S. 645.
