Anthocyane
Anthocyane oder Anthozyane (von altgriechisch ἄνθος ánthos „Blüte, Blume“ und κυανός kyanós „dunkelblau, schwarzblau, dunkelfarbig“) sind wasserlösliche Pflanzenfarbstoffe, die im Zellsaft nahezu aller höheren Pflanzen vorkommen und Blüten und Früchten eine intensive rote, violette oder blaue Färbung verleihen.


1835 gab der deutsche Apotheker Ludwig Clamor Marquart in seiner Abhandlung „Die Farben der Blüthen“ erstmals den Namen Anthokyan einer chemischen Verbindung, die Blüten eine blaue Färbung verleiht. 1849 konnte von F. S. Morot dieser als „Cyanin“ bezeichnete Farbstoff in unreiner Form isoliert werden. 1913 gelang Richard Willstätter die Identifizierung des Anthocyans der Kornblume. Später wurde dieser Begriff zur Bezeichnung einer ganzen Gruppe von Verbindungen eingeführt, die chemisch dem ursprünglichen „Blumenblau“ ähneln. Man erkannte auch schnell, dass die Kristallisation der Oxonium-Farbstoffsalze (Flavyliumsalze) erheblich leichter fiel als das Fällen der neutralen (chinoiden) Farbstoffe.
Anthocyane gehören zur Gruppe der flavonähnlichen Stoffe, den Flavonoiden, und werden zu den sekundären Pflanzenstoffen gezählt.
Die gute Wasserlöslichkeit verdanken sie einem glycosidisch gebundenen Zuckeranteil. Farbbestimmend ist einzig der zuckerfreie Anteil, das Aglycon des Anthocyans, das daher auch Anthocyanidin genannt wird. Die meisten und wichtigsten Anthocyane leiten sich von Cyanidin und Delphinidin ab.
Im Englischen wird anstelle der Bezeichnung „Anthocyan“ ausschließlich der Begriff „anthocyanin“ verwendet.
Vorkommen
| Lebensmittel | Anthocyane [mg/100 g Frucht][1][2][3][4] |
|---|---|
| Holundersaft | 1900–6600 mg/100 ml als Cyanidin |
| Johannisbeersaft (schwarz) | 1300–4000 mg/100 ml |
| Kohlpalme | 800–1000 |
| Aubergine (Schale) | 750 als Delphinidin |
| Hibiskus | 500–1500 Delphinidin und Cyanidin (2:1) |
| Apfelbeere (Aronia) | 200–1000 als Cyanidin |
| Holunderbeere | 200–1000 als Cyanidin |
| Blutorange (Fruchtfleisch) | 200 als Cyanidin |
| Himbeere (schwarz) | 180–700 |
| Johannisbeere (schwarz) | 130–420 Delphinidin und Peonidin (2:1) |
| Brombeere | 50–350 als Cyanidin |
| Sauerkirsche | 35 als Cyanidin |
| Preiselbeere | 25–65 als Cyanidin |
| Himbeere (rot) | 20–230 als Cyanidin |
| Rotkohl (Blaukraut) | 12–40 als Cyanidin |
| Heidelbeere (Blaubeere) | 10–515 als Cyanidin |
| Apfel (Schale) | 10–100 |
| Johannisbeere (rot) | 10–20 |
| Erdbeere | 7–50 als Pelargonidin |
| Traube (rot) | 5–750 (stark sortenabhängig) |
| Rotwein | 2–1000 mg/100 ml als Malvidin |
| Kirsche | 2–450 als Cyanidin |
Anthocyane sind chymochrome Farbstoffe, die nur im Zellsaft von Landpflanzen, nicht aber in Tieren, Mikroorganismen oder Wasserpflanzen zu finden sind. Bei Wasserpflanzen ist der Umsatz der Photosynthese aufgrund der geringen Lichtintensität unter Wasser nicht ausreichend für die Produktion. Aber auch nicht alle Landpflanzen enthalten Anthocyane: bei den Nelkenartigen, Kakteen und Mollugogewächsen übernehmen Betalaine die Aufgabe der Anthocyane.

Anthocyane kommen nahezu in allen höheren Pflanzen, meist in den Blüten und Früchten, aber auch in den Blättern und Wurzeln vor. In den jeweiligen Pflanzenteilen sind sie vor allem in den äußeren Zellschichten wie den Epidermiszellen zu finden. Die dort gefundenen Mengen sind relativ groß: Ein Kilogramm Brombeeren enthält zum Beispiel etwa 1,15 Gramm Anthocyane, aus roten und schwarzen Hülsenfrüchten lassen sich bis zu 20 Gramm pro Kilogramm Schale gewinnen. Reich an Anthocyanen sind zum Beispiel die Açaí-Beere, Aronia, Kirschen, blaue Trauben, Heidelbeeren und Rotkohl sowie Usambaraveilchen. Weniger verbreitet sind Anthocyane zum Beispiel in Bananen, Spargel, Erbsen, Fenchel, Birnen sowie Kartoffeln. Am häufigsten kommen in der Natur die Glycoside von Pelargonidin, Cyanidin, Delphinidin sowie deren Methylether Malvidin, Peonidin und Petunidin vor. Schätzungsweise werden 2 % des gesamten Kohlenstoffs, der durch die Photosynthese in den Pflanzen fixiert wird, zu Flavonoiden und deren Derivaten wie den Anthocyanen umgesetzt. Das sind nicht weniger als 109 Tonnen pro Jahr.
In den Pflanzen liegen die Anthocyane zusammen mit anderen natürlichen Farbstoffen wie den chemisch eng verwandten Flavonen, den Carotinoiden, Anthoxanthinen und Betalainen vor. Sie sind neben diesen auch für die Färbung der Blätter im Herbst verantwortlich, wenn die Photosynthese eingestellt und das Chlorophyll nicht neu gebildet wird.

Auch bei noch relativ jungen Pflanzen, bei denen die Chlorophyll- und Wachsproduktion noch nicht eingesetzt hat und die somit vor UV-Licht ungeschützt wären, werden vermehrt Anthocyane produziert. Teile oder sogar die ganze Pflanze werden mit Hilfe der Farbstoffe, die als Jugendanthocyane bezeichnet werden, eingefärbt und geschützt. Wenn die Chlorophyllproduktion beginnt, wird die Produktion der Anthocyanfarbstoffe herabgesetzt. Das Muster der Anthocyanbildung in Pflanzen ist für die Pflanzenart spezifisch, da es von den Bodenbedingungen, Licht, Wärme und Pflanzenart beziehungsweise Sorte abhängt. Dass Pflanzen nur ein Anthocyan als Farbstoff aufweisen, ist äußerst selten, kommt aber dennoch vor. Das Fehlen oder besonders starke Vorkommen eines bestimmten Anthocyans in einer Pflanze ist auf genetische Umstände zurückzuführen.
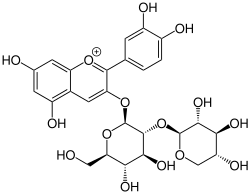 Cyanidin-3-O-sambubiosid (Holunder)
Cyanidin-3-O-sambubiosid (Holunder)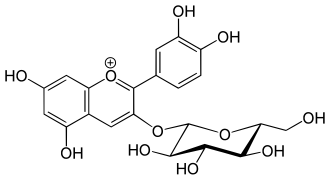 Cyanidin-3-O-glucosid (Holunder)
Cyanidin-3-O-glucosid (Holunder)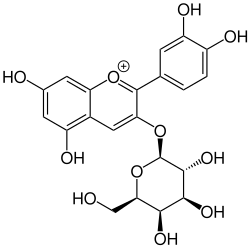 Cyanidin-3-O-galactosid (Aronia)
Cyanidin-3-O-galactosid (Aronia)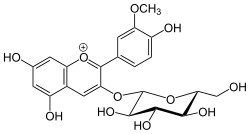 Peonidin-3-O-glucosid (schwarze Johannisbeere)
Peonidin-3-O-glucosid (schwarze Johannisbeere)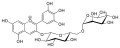 Delphinidin-3-O-rutinosid (schwarze Johannisbeere)
Delphinidin-3-O-rutinosid (schwarze Johannisbeere)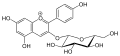 Pelargonidin-3-O-glucosid (Erdbeere)
Pelargonidin-3-O-glucosid (Erdbeere)
Aufgabe in Pflanzen
Pflanzenhäute sind in der Regel dunkler gefärbt als das Pflanzeninnere, Ausnahmen bilden jedoch beispielsweise Blutorangen. Pflanzenhäute sind also in der Lage, sichtbares Licht zu absorbieren und Teile der Strahlungsenergie in Wärmeenergie umzuwandeln. Die Anthocyane haben in den Pflanzen weitere Aufgaben: Sie sollen
- in der Schale das kurzwellige UV-Licht der Sonne absorbieren und die Strahlungsenergie als Wärme an die Pflanze abgeben. So wird eine Schädigung der Proteine in der Zelle und der DNA in den Zellkernen verhindert.
- durch ihre Farbe Insekten und andere Tiere anlocken und so bei der Vermehrung der Pflanzen helfen.
- Freie Radikale im Pflanzensaft binden, die bei oxidativem Stress entstehen.
Die ersten beiden Punkte erklären auch, warum die Anthocyane sich in den äußeren Schichten der Pflanzenteile finden: Nur hier können sie ihre Aufgabe erfüllen. Wenn Pflanzen nun starkem UV-Licht oder ionisierender Strahlung ausgesetzt werden, regt die Pflanze über chemische Botenstoffe die Anthocyanproduktion an.
Struktur
Grundlegende Strukturaufklärungen auf dem Gebiet der Pflanzenfarbstoffe wurden von Richard Willstätter durchgeführt und 1915 mit dem Nobelpreis für Chemie gewürdigt.
| Anthocyanidin | CAS (a) | Grundstruktur (R3 = OH, R6 = H) | R1, R2 | - | R5 | R7 | - | λmax(b) | - | pKS1[5][6][7] | pKS2 | pKS3 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pelargonidin(c) | 134-04-3 | 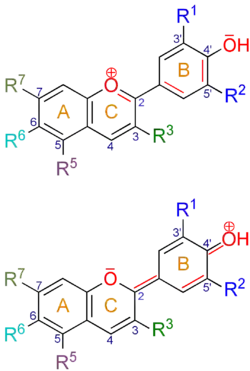 |
H, H | OH | OH | 506 nm | n.b. | .... | .... | |||
| Cyanidin(c) | 528-58-5 | OH, H | OH | OH | 525 nm | 2,98 ± 0,05 | 7,5 | .... | ||||
| Peonidin (Paeonidin) | 134-01-0 | OCH3, H | OH | OH | 523 nm | 2,09 ± 0,10 | 6,8 | .... | ||||
| Rosinidin | 4092-64-2 | OCH3, H | OH | OCH3 | .... | .... | .... | |||||
| Delphinidin(c) | 528-53-0 | OH, OH | OH | OH | 535 nm | 1,56 ± 0,20 | 5,85 | .... | ||||
| Petunidin | 1429-30-7 | OCH3, OH | OH | OH | 535 nm | .... | .... | .... | ||||
| Malvidin | 643-84-5 | OCH3, OCH3 | OH | OH | 535 nm | 1,76 ± 0,07 | 5,36 ± 0,04 | 8,39 ± 0,07 | ||||
|
(b) UV-Absorption der 3-Glucoside in Methanol mit 0,01 % HCl.[4] Anthocyanidine absorbieren Licht ca. 10 nm langwelliger als Anthocyanidine-Glycoside (d. h. Blauverschiebung durch den Glycosidrest, siehe hypsochromer Effekt).[8] | ||||||||||||

Anthocyanidine weisen in Position 2 immer einen p-Hydroxyphenyl-Substituenten (B-Ring) sowie in Position 3 eine Hydroxygruppe auf. Als Gegenion von Benzopyrylium-Salzen fungieren in der Natur meist Carboxylate diverser wasserlöslicher Säuren, bei Laborpräparaten häufig Chlorid. Die wichtigsten natürlichen Anthocyanidine sind in 5- und 7-Position des A-Rings hydroxysubstituiert.
Bei den Glycosiden der Anthocyanidinen, den Anthocyanen (engl. anthocyanosides, anthocyanins), sind in der Regel an der Hydroxygruppe am Kohlenstoffatom C-3 Zuckermoleküle über eine O-glycosidische Bindung gebunden. Das können beispielsweise Glucose, Galactose, Arabinose, Rhamnose und Xylose in verschiedenen Saccharid-Formen sein. Durch Acylierung mit aromatischen Pflanzensäuren an diesen ergibt sich die Vielfalt der Anthocyane. Die Glycosidform verleiht den Molekülen eine erhöhte Wasserlöslichkeit, die wichtig für den Transport in den Pflanzenzellen ist, sowie eine erhöhte Stabilität.
Eigenschaften
Anthocyane sind licht- und temperaturempfindlich, bei pH-Werten unter 3 sind sie in Form ihrer Flavyliumsalze am stabilsten. Mit Tanninen reagieren Anthocyane und fallen aus wässrigen Lösungen aus. Oxidationsmittel entfärben Anthocyane, besonders empfindlich sind sie im alkalischen Bereich.
Anthocyane absorbieren Licht im sichtbaren Bereich zwischen 450 und 650 nm. Der Wellenlängenbereich wird außer von der Molekülstruktur auch vom pH-Wert des Zellsaftes bzw. der Umgebung beeinflusst und sie erscheinen daher rot, violett oder blau. Licht dieser Wellenlängen wird aus dem sichtbaren Licht herausgefiltert und der reflektierte Lichtanteil erscheint uns als eine Farbe. Das Farbspektrum reicht dabei von blau bis rot. Im sauren Milieu überwiegt die Rotfärbung, im basischen sind vor allem Blau- und Violetttöne zu finden. Farbumschläge finden auch in einigen Pflanzen statt: Die Blüten des Lungenkrauts (Pulmonaria officinalis) sind zuerst rosa, später violett gefärbt, da sich der pH-Wert im Laufe des Lebens ändert. Die Beerenhaut von Brombeeren färbt sich während des Reifens von rosa nach tiefblau, deren süßsäuerlicher Saft ist dagegen tiefrot.

pH-Abhängigkeit der Farbe

Die Farbänderungen der Anthocyane beruhen auf chemischen Reaktionen.[9] So sind mit den Bezeichnungen „Rotkohl“ und „Blaukraut“ keine unterschiedlichen Kohlsorten gemeint, sondern die Gerichte unterscheiden sich bei der Zubereitung einzig durch einen unterschiedlichen Zusatz von Essig beim Kochen.
- Bei pH-Werten unter 3 sind Anthocyane rot gefärbt und liegen in Form von Flavyliumkationen vor.
- pH-Werte zwischen 4 und 5 führen durch Hydroxylierung zu farblosen Carbinol-Pseudobasen („Leucobasen“, Chromenol), womit die Anthocyane ihre Aufgaben in den Pflanzen nicht mehr erfüllen können.
- Bei pH-Werten zwischen 5 und 7 liegen Anthocyane als Flavenole mit chinoider Struktur vor und sind purpur.
- Bei pH-Werten zwischen 7 und 8 wird dieses Molekül zum Flavenolatanion deprotoniert, das eine blaue Farbe aufweist. Hier sind die Π-Elektronen im gesamten Molekül über eine längstmögliche Distanz delokalisiert und daher mit niedrigster Lichtenergie anregbar.
- pH-Werte ab 8 führen bei Fehlen von Glycosidgruppen in 5-Position auch zu Flavenolat-Dianionen, jedoch konkurriert im Alkalischen die hydrolytische Öffnung des Pyranringes. Das Molekül wird dabei irreversibel zu einem gelben[10] Chalkon-Anion umgewandelt.[11]
- Verglichen mit den pKS-Werten von Dihydroxybenzolen (pKS ca. 9,5 und 11,7) sind Anthocyanidine mehr als 1000-fach acider. Flavyliumsalze in Wasser sind mehr als 10-fach saurer als Ameisensäure (pKS 3,8).
 VIS-Spektren von Malvidin-3-glucosid bei verschiedenen pH-Werten
VIS-Spektren von Malvidin-3-glucosid bei verschiedenen pH-Werten VIS-Spektren von Cyanidin-3-glycosiden bei verschiedenen pH-Werten (Holundersaft)
VIS-Spektren von Cyanidin-3-glycosiden bei verschiedenen pH-Werten (Holundersaft)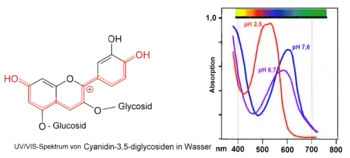 VIS-Spektren von Cyanidin-3,5-diglycosiden bei verschiedenen pH-Werten (Rotkohlsaft)
VIS-Spektren von Cyanidin-3,5-diglycosiden bei verschiedenen pH-Werten (Rotkohlsaft) Blauer Delphinidin-Aluminium-Komplex
Blauer Delphinidin-Aluminium-Komplex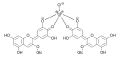 Blauer Delphinidin-Eisen-Komplex
Blauer Delphinidin-Eisen-Komplex.jpg.webp) Blaue Hortensien
Blaue Hortensien
Metallkomplexe
Anthocyane mit benachbarten Hydroxygruppen im B-Ring bilden in Gegenwart von Aluminium- oder Eisensalzen Metallkomplexe. Die Komplexierung der Metallionen führt dazu, dass das Absorptionsmaximum der Verbindungen um 14–23 nm[4] zu kürzeren Wellenlängen (Blauverschiebung, hypsochrome Verschiebung) verschoben wird.[7] Sigurdson und Giusti beschreiben eine Verschiebung des Absorptionsmaximums von Anthocyanen um bis zu 50 nm zu längeren Wellenlängen (bathochrome Verschiebung) durch Zugabe von Al-Ionen.[12] Dies verleiht komplexierten Anthocyanen eine blaue bis violette Färbung. Hortensien bilden ihre blaue Färbung aus Delphinidin in Gegenwart von Aluminium- oder Eisensalzen im Erdreich.
Biosynthese

Die Bildung der Anthocyane folgt der Biosynthese aller Flavonoide (siehe dazu: Biosynthese). Eine biologische Vorstufe sind die oligomeren Proanthocyanidine. Als Schlüsselenzym des Anthocyan-Syntheseweges wurde die Chalkonsynthase (CHS) identifiziert, deren Expression auf mRNA-Ebene reguliert wird. Verschiedene Außenfaktoren, Umwelteinflüsse wie Temperatur, Licht und Wasserverfügbarkeit, haben darauf Einfluss. Aber auch Pflanzenstress kann eine Rolle spielen.

Bei Keimlingen wird etwa die Synthese des so genannten Jugendanthocyans in den Keimblättern und im Hypokotyl durch den Rot- und Blaulichtanteil im Sonnenlicht angeregt, der durch die als Photorezeptoren funktionieren Moleküle Phytochrom (Rotlicht) und Kryptochrom (Blaulicht) registriert wird. Ausgewachsene Pflanzen produzieren vor allem bei ultravioletter Belichtung, die für die Pflanze Stress bedeutet, Anthocyane in Blättern und dem Spross. Dabei stellen die Anthocyane wahrscheinlich nur die stabilen Endprodukte der Synthese dar, wichtig für den Schutz der Pflanze sind jedoch die UV-absorbierenden Vorstufen.
Auch bei der Laubfärbung im Herbst werden Anthocyane gebildet, die den Rotanteil des Herbstlaubes ausmachen. Dabei sind die Anthocyanide hier das Endprodukt des Zimtsäureweges, der durch den Abbau von Phenylalanin angestoßen wird. In Pflanzen, die durch Symbiose mit Bakterien Stickstoff fixieren, findet man diesen Stoffwechselweg nicht. Daher bleibt hier eine Herbstfärbung durch Anthocyane aus.
Grundsätzlich werden Anthocyanide in Blättern immer nur in der äußersten Schicht, der Epidermis, gebildet. In Sprossorganen bilden sich die Anthocyanide in der darunter liegenden Subepidermis und in Blattorganen vor allem nahe der Blattvenen und dem Blattrand. Zurückzuführen ist diese lokale Beschränkung auf die Existenz genetischer Transkriptionsfaktoren in diesen Bereichen, die eine Synthese der Anthocyanide als Reaktion auf bestimmte Faktoren erst ermöglichen. Man spricht in diesem Zusammenhang von einem Kompetenzmuster.
Gewinnung und Verwendung
Die Gewinnung von Anthocyan-Extrakten erfolgt zumeist aus Fruchtschalen von Früchten mit hoher Anthocyankonzentration, wie zum Beispiel Blaubeeren. Für die Isolierung von hochkonzentrierten Anthocyan-Mischungen werden Extraktion und chromatographische Methoden gekoppelt.
Die Früchte werden in einem Mixer stark homogenisiert und mit angesäuerter Ethanol-Lösung versetzt. Nach einer ersten Filtration wird der Rückstand auf gleiche Weise extrahiert. Die klare, gesammelte Lösung wird eingeengt und vier Mal je mit Ethylacetat versetzt und ausgeschüttelt. Die wässrige Lösung wird gesammelt, auf vier Grad Celcius gekühlt und auf eine Säule mit Kationen-austauschendem Polystyrolharz auf Sulfonsäurebasis (Amberlite XAD-7HP) gepackt. Die Säule wird zuerst mit demineralisiertem Wasser gespült um andere organische Reste wie Zucker zu entfernen. Für die Eluirung der Anthocyane wird wieder angesäuerte ethanolische Lösung zugegeben und die Probe eluiert. Die gesammelte, ethanolische Lösung wird mit demineralisiertem Wasser versetzt und in eine zweite Säule (Sephadex LH-20) auf Hydroxypropyl-Basis gegeben. Die Säule wird ein weiteres Mal mit angesäuerter, ethanolischer Lösung eluiert und die Fraktionen chromatographisch getrennt. Aus den Fraktionen der Säulenchromatographie können durch semi-preparative HPLC (LC-6AD) hochkonzentrierte Anthocyane gewonnen werden. Nach der Separierung durch die HPLC können die Produkte über UV-Vis-Spektroskopie analysiert werden.
In der EU sind Anthocyane als Lebensmittelzusatzstoff unter der E-Nummer E 163[13] ohne Höchstmengenbeschränkung (quantum satis) für Lebensmittel allgemein zugelassen. (Glycoside von Pelargonidin E 163a, Cyanidin E 163b, Peonidin E 163c, Delphinidin E 163d, Petunidin E 163e, Malvidin E 163f). Sie werden als Lebensmittelzusatzstoff zur Färbung zum Beispiel Fruchtgelees, Süßwaren, Brausen, Marmelade, Konfitüren, Obstkonserven, Backmitteln für feine Backwaren, Überzüge und Speiseeis zugesetzt. Meist werden sie sauren Produkten zugesetzt, da sie nur in diesen stabil sind. Eine Verwendung wäre bei einigen Lebensmitteln ohnehin nicht erlaubt, da eine Täuschungsgefahr bestünde, wie etwa bei Brot, verschiedenen Milchprodukten, Nudeln und Honig.
Als Farbstoffe in der Kunst werden sie wegen ihrer fehlenden Stabilität nicht benutzt.
Analytik
Anthocyane lassen sich am leichtesten mittels chromatographischer Methoden wie zum Beispiel HPLC, meist mit gekoppeltem Massenspektrometer (LCMS), identifizieren und quantifizieren. Bei der HPLC bietet sich eine C18-Reversed-Phase (siehe HPLC) an.[14] Kleinere Mengen sind auch mit einem elektrochemischen, größere ebenfalls mit einem photometrischen Detektor bestimmbar.
Bei der Analyse ist es vorteilhaft, den pH-Wert mit Säuren wie zum Beispiel Ameisensäure auf unter 3 zu erniedrigen, da die Anthocyane unter diesen Bedingungen am stabilsten sind. Da Pflanzen ein spezifisches Anthocyanidin/Glycosid-Verteilungsmuster aufweisen, wird durch HPLC-Analyse der Inhaltsstoffe nachgewiesen, ob beispielsweise ein Wein aus einem bestimmten Anbaugebiet stammt und um welche Rebsorte es sich handelt. Bei längerer Lagerung von Weinen entstehen zunehmend Polymere der Anthocyane, daher kann durch Messung des sogenannten Monomerindex das Alter eines Weins bestimmt werden. Polymere der Anthocyane entstehen durch oxidative (radikalisch verlaufende) Kupplungen der im neutralen dominierenden chinoiden Verbindungen.
Physiologie
Die Anthocyane aus rotem Traubensaft und schwarzem Johannisbeersaft werden nur in geringem Umfang vom Körper aufgenommen und/oder schnell metabolisiert, wie aus geringen Anthocyan-Konzentrationen sowohl im Blutplasma (pH 7,4) als auch im Urin geschlossen wurde. Die tägliche Aufnahmemenge schwankt von Mensch zu Mensch stark, sodass Durchschnittswerte kaum Aussagekraft besitzen. Die Bioverfügbarkeit der Anthocyane liegt bei Aufnahme mit normaler Nahrung nur bei etwa 1 Prozent.
Anthocyane haben antioxidative Wirkung, die die von Vitamin C und Vitamin E, zumindest in vitro, um ein Vielfaches übersteigen kann. Es wird jedoch bezweifelt, dass die Anthocyane auch in vivo diese starke antioxidative Wirkung entfalten können, da die Bioverfügbarkeit schlecht ist. Im menschlichen Körper binden sie freie Radikale und schützen somit die DNA sowie Lipide und Kohlenhydrate vor Schädigung. Den Anthocyanen werden noch andere Wirkungen zugeschrieben: Sie sollen Sehvorgänge verbessern, entzündungshemmend und gefäßschützend wirken.
Anthocyane sind nur in sehr geringem Maße toxisch. Aus Pflanzen aufgenommene Anthocyane stellen keine Gefahr dar.
Einzelnachweise
- Jens Fleschhut: Untersuchungen zum Metabolismus, zur Bioverfügbarkeit und zur antioxidativen Wirkung von Anthocyanen. Dissertation 2004; Tabellen 1.2 und 1.3. (doi.org/10.5445/IR/1000002640) urn:nbn:de:swb:90-26403
- Lidija Jakobek, Marijan Seruga, Martina Medvidovic-Kosanovic, Ivana Novac: Anthocyanin content and antioxidant activity of various red fruit juice. In: Deutsche Lebensmittel-Rundschau. 103. Jahrgang, Heft 2, 2007. (bib.irb.hr)
- M. Buchweitz, D. R. Kammerer, R. Carle: Signifikante Verbesserung: Stabilisierung von Anthocyanen mit Hydrokolloiden. In: Lebensmitteltechnik. 2012, S. 42–43. (online (Memento vom 29. Oktober 2013 im Internet Archive; PDF; 2,1 MB))
- H.-D. Belitz, Hans-Dieter Belitz, Werner Grosch, Peter Schieberle: Lehrbuch der Lebensmittelchemie. 5., vollst. überarb. Auflage. Springer, Berlin [u. a.] 2001, ISBN 3-540-41096-1, S. 814, Tab. 18.22.
- pKa-Wert-Bestimmung (PDF; 185 kB).
- Robert E. Asenstorfer, Patrick G. Iland, Max E. Tate, Graham P. Jones: Charge equilibria and pKa of malvidin-3-glucoside by electrophoresis. In: Analytical Biochemistry. Vol. 318, Nr. 2, 15. Juli 2003, S. 291–299. (doi:10.1016/S0003-2697(03)00249-5).
- Josh Hurwitz: Farbeigenschaften der Delphinidin-3-Monoglucoside bei verschiedenen pH-Werten. Abgerufen am 24. März 2024..
- 4.1.3 Abspaltung der glycosidischen Reste an Anthocyanen (Memento vom 4. Oktober 2013 im Internet Archive). (PDF; 109 kB).
- Naturstoffe als pH-Indikatoren.
- Gelbe Farbstoffe absorbieren unter 400 nm, vgl. Quercetin, Chalcon bei 350 nm.
- Pericles Markakis (Hrsg.): Anthocyanins as Food Colors. Elsevier, Oxford 2012, ISBN 978-0-323-15790-2, S. 17 (eingeschränkte Vorschau in der Google-Buchsuche).
- Gregory T. Sigurdson, M. Monica Giusti: Bathochromic and Hyperchromic Effects of Aluminum Salt Complexation by Anthocyanins from Edible Sources for Blue Color Development. In: Journal of Agricultural and Food Chemistry. Band 62, Nr. 29, 23. Juli 2014, S. 6955–6965, doi:10.1021/jf405145r.
- Eintrag zu E 163: Anthocyanins in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 16. Juni 2020.
- S. Koswig, H.-J. Hofsommer: HPLC-Methode zur Untersuchung von Anthocyanen in Buntsäften und anderen gefärbten Lebensmitteln. In: Flüssiges Obst. Band 62, Nr. 4, 1995, S. 125–130.
Literatur
- E. Bayer: Komplexbildung und Blütenfarben. In: Angew. Chem., Bd. 78, Nr. 18–19, 1966, S. 834–841. doi:10.1002/ange.19660781803.
- K. Herrmann: Anthocyanin-Farbstoffe in Lebensmitteln. In: Ernährungs-Umschau. Bd. 33, Nr. 9, 1986, S. 275–278.
- K. Herrmann: Hinweise auf eine antioxidative Wirkung von Anthocyaninen. In: Gordian. Bd. 95, Nr. 5, 1995, S. 84–86.
- M. N. Clifford: Anthocyanins – nature, occurrence and dietary burden. In: Journal of the Science of Food and Agriculture. Bd. 80, Nr. 7, 2000, S. 1063–1072. doi:10.1002/(SICI)1097-0010(20000515)80:7<1063::AID-JSFA605>3.0.CO;2-Q.
- G. Mazza, E. Miniati: Anthocyanins in fruits, vegetables, and grains. CRC Press, Boca Raton 1993, ISBN 0-8493-0172-6.
- H. Halbwirth: The Creation and Physiological Relevance of Divergent Hydroxylation Patterns in the Flavonoid Pathway. in Int J Mol Sci. Bd. 11, 2010, S. 595–621, PMC 2852856 (freier Volltext).
- Maria Claudia Lazzè, Monica Savio, Roberto Pizzala, Ornella Cazzalini, Paola Perucca, Anna Ivana Scovassi, Lucia Anna Stivala, Livia Bianchi: Anthocyanins induce cell cycle perturbations and apoptosis in different human cell lines. In: Carcinogenesis. Band 25, Nr. 8, 2004, S. 1427–1433, doi:10.1093/carcin/bgh138.
- E. Wang, Y. Yin, C. Xu, J. Liu: Isolation of high-purity anthocyanin mixtures and monomers from blueberries using combined chromatographic techniques. In: J Chromatogr A. 1327, 31. Jan 2014, S. 39–48. doi:10.1016/j.chroma.2013.12.070. Epub 2013 Dec 30. PMID 24433700.