Bromeliengewächse
Die Bromeliengewächse (Bromeliaceae), auch Ananasgewächse genannt, sind eine Pflanzenfamilie in der Ordnung der Süßgrasartigen (Poales) innerhalb der Einkeimblättrigen Pflanzen (Monokotyledonen). Die 58 bis 62 Gattungen mit 2900 bis 3180 Arten sind in der Neotropis beheimatet. Am bekanntesten sind die Früchte der Ananas (Ananas comosus). Eine Reihe von Arten und ihre Sorten werden als Zierpflanzen verwendet.
| Bromeliengewächse | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
_001.jpg.webp)
Guzmania berteroniana | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Bromeliaceae | ||||||||||||
| Juss. |
Beschreibung
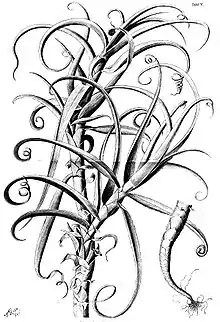


Erscheinungsbild
Fast alle Arten der Bromeliaceae sind immergrüne, ausdauernde krautige Pflanzen. Ausnahmen sind wenige plurienne hapaxanthe Pflanzen, diese Arten sterben nach der Blüten- und Samenbildung völlig ab: das beeindruckendste Beispiel ist Puya raimondii, sie braucht viele Jahrzehnte (50 bis 70 Jahre), um den größten Blütenstand aller Pflanzenarten zu bilden. Eine andere Ausnahme sind wenige Arten, die in der Trockenzeit laubabwerfend sind, wie zum Beispiel Pitcairnia heterophylla.
Meistens besitzen Bromelien eine gestauchte Sprossachse, also eine Blattrosette als typische Wuchsform. Es gibt allerdings auch einige Arten, deren Sprossachse nicht gestaucht ist und die kleine Stämmchen bilden. Viele Arten sind mehr oder weniger ausgeprägt Xerophyten, sie besitzen also unterschiedliche Möglichkeiten die Verdunstung zu verringern.[1] Etwa zwei Drittel der Arten verfügen über CAM-Metabolismus.
Wurzeln
Wie bei allen monokotyledonen Pflanzen stirbt die Primärwurzel kurz nach der Keimung ab und es bilden sich Adventivwurzeln, sogenannte sprossbürtige Wurzeln. Die terrestrischen Arten besitzen oft ein wohl ausgebildetes Wurzelsystem. Die Wurzeln bei den epiphytischen Arten dienen vor allem der Befestigung des Pflanzenkörpers auf dem Untergrund. Bei wenigen Arten (beispielsweise Tillandsia usneoides) werden nach dem Absterben der Primärwurzel keine weiteren Wurzeln gebildet.[1]
Blätter
Die wechselständig und spiralig angeordneten, einfachen, parallelnervigen Laubblätter sind meist in Blattspreite und Blattscheide gegliedert; sie besitzen aber meist keinen Blattstiel (Ausnahme beispielsweise einige Pitcairnia-Arten). Ausnahme ist eine zweizeilige Anordnung der Blätter besonders in der Untergattung Diaphoranthema der Gattung Tillandsia. Die Formen der Blattspreite reichen von linealisch über zungenförmig bis breit dreieckig. Die Blattränder sind bestachelt oder unbestachelt.[2] Bei wenigen Arten (beispielsweise Tillandsia duratii) sind die Blattspitzen eingerollt und dienen der Verankerung der Pflanzen an Zweigen.
Ein charakteristisches Merkmal ist der Besitz von Schuppenhaaren (Saugschuppen, Trichome) auf den Blättern, mit denen diese Pflanzen den Niederschlag und Nährstoffe direkt, ohne Umweg über die Wurzeln, aufnehmen. Die Saugschuppen sitzen entweder sichtbar auf der Blattoberfläche – dann sieht das Blatt mehr oder weniger grau aus – oder innerhalb der Blatttrichter im Wasservorrat. Die Struktur der Saugschuppen kann mehr oder weniger kompliziert sein – je später (Evolution) die Art entstanden ist, desto komplizierter der Aufbau (bei Pitcairnioideae und Bromelioideae einfacher als bei Tillandsioideae und auch innerhalb der Unterfamilien und Gattung lässt sich eine solche Progressionreihe nachweisen).[3] Die Saugschuppen bestehen immer aus dem sogenannten Schild oder Trichomdeckel und den Wasseraufnahmezellen. Der Schild besteht aus vier Zentralzellen, die von acht Zellen und die wiederum von 16 Zellen umgeben sind. Bei fortschrittlichen Taxa werden diese Ringe von Zellen noch von einem „Flügel“ aus 64 Zellen umgeben. Alle Schildzellen sind abgestorben und besitzen dicke Wände. Ihnen schadet also ein Austrocknen nicht und sie sind hygroskopisch; wenn sie trocken sind dann sind sie oft gefaltet. Bei Trockenheit ist Luft in den Zellen eingeschlossen und sie wirken dadurch grau, silbrig bis weiß, während die Zellen wenn sie feucht sind viel grüner wirken. Die Wasseraufnahmezellen im Zentrum der Saugschuppe sind untereinander in einer Reihe angeordnet und sind in der Epidermis eingesenkt; es sind lebende Zellen. Die Wasseraufnahmezellen stellen die Verbindung mit dem Blattgewebe her. Die Schuppenhaare dienen auch als Verdunstungs- und Einstrahlungsschutz.[4]
Blütenstände und Blüten
Die Blüten und Früchte stehen meist in sehr unterschiedlich gestalteten, einfachen oder zusammengesetzten, traubigen oder rispigen Blütenständen (Infloreszenzen) zusammen. Die meist sehr dekorativen Hochblätter (Brakteen) und Tragblätter der Blütenstände dienen der Anlockung der Bestäuber (neben tag- oder nachtaktiven Insekten auch Vögel und Fledertiere). Bei wenigen Arten ist nur eine Blüte vorhanden (beispielsweise Tillandsia usneoides).
_1-00128.jpg.webp)
Wichtiges Kennzeichen ist die mit den übrigen Einkeimblättrigen gemeinsame Dreizähligkeit der Blüten. Die meist zwittrigen und oft radiärsymmetrischen, seltener zygomorphen Blüten besitzen ein doppeltes Perianth. Nur bei einer kleinen Zahl von Arten sind die Blüten eingeschlechtig oder funktionell eingeschlechtig. Dann können die Arten einhäusig oder zweihäusig getrenntgeschlechtig sein; Beispiele: die Gattungen Androlepis, Hechtia und einige Arten in Catopsis und Dyckia. Die drei Kelchblätter sind frei oder verwachsen. Die drei Kronblätter sind meist frei; nur bei den Arten der Gattungen Cryptanthus, Greigia, Guzmania, Mezobromelia, Navia, Neoregelia und Nidularium sind sie untereinander verwachsen. Bei einigen Gattungen sind an der Basis der Kronblätter zwei kleine Schuppen (Ligulae) vorhanden; das Fehlen oder Vorhandensein ist oft ein wichtiges Bestimmungsmerkmal. Es sind zwei Kreise mit je drei Staubblättern vorhanden. Pitcairnioideae und Tillandsioideae bilden monocolpate Pollen mit einer langgestreckten Apertur und Bromelioideae bilden oft porate Pollen mit runden Aperturen. Drei Fruchtblätter sind zu einem ober- bis unterständigen Fruchtknoten verwachsen. Der Griffel ist zylindrisch und meist gerade oder manchmal gebogen. Die Narbe besitzt drei freie oder verwachsene Narbenlappen. Es sind Scheidewand-Nektarien vorhanden.
Die Blütenformel lautet: oder oder
Früchte und Samen
Die Früchte und Samen sind in den Unterfamilien (siehe dort) sehr verschieden: es werden dreifächerige, septizide, trockene Kapselfrüchte oder Beeren mit einer Vielzahl von Samen gebildet. Die Gattungen Ananas sowie die Pseudananas und Acanthostachys aus der Unterfamilie der Bromelioideae bilden einen genießbaren Fruchtverband (Synkarpium) als Beeren.[1]
Die Samen sind ungeflügelt oder geflügelt oder besitzen fallschirmartigen Anhängsel. Die Samenausbreitung erfolgt außer bei den Bromelioideae durch den Wind. Die Beeren der Bromelioideae werden von Tieren gefressen, welche die Samen unverdaut ausscheiden. Die Flughaare der Tillandsioideae lassen die Samen relativ fest auf ihrer Unterlage haften, wenn sie feucht sind.[1] Dadurch ist sichergestellt, dass die Keimung nur dort stattfindet, wo hinreichend Wasser für das weitere Wachstum vorhanden ist.
Chromosomensätze
Die Chromosomenzahl beträgt meist 2n = 50, es liegt also meist eine Basiszahl von x = 25 vor. Sie kann aber auch in der Gattung Cryptanthus nur 2n = 34, bei Ayensua uaipanensis 2n = 46 oder bis zu 2n = 150 bei Orthophytum-Arten betragen. Polyploidie spielt in der Chromosomenevolution bei den Bromeliaceae eine große Rolle; beispielsweise gibt es bei Orthophytum und Bromelia Arten mit 2n = 100 tetraploide Karyotypen und auch hexaploide mit 2n = 150.[5][6]
.jpg.webp)

Ökologie
Sie wachsen sowohl epiphytisch (etwa 1700 Arten, also mehr als die Hälfte) auf Bäumen (Stamm oder Ast) oder anderen Pflanzen (beispielsweise Kakteen) oder an Felsen (lithophytisch), aber auch auf dem Boden, also terrestrisch. Oft gedeihen sie an hydrisch schwierigen Standorten, an denen der Untergrund zeitweilig völlig austrocknet, oder im Kronenbereich der Bäume (Kronenbereiche der Bäume in den Tropen sind sehr extreme Standorte mit hoher Sonneneinstrahlung und hoher Evapotranspiration). Arten mit vielen Schuppenhaaren kommen meist in Gebieten mit schwierigen Klimaverhältnissen vor, beziehungsweise besiedeln höhere Etagen der Urwaldbäume. Arten auf denen keine Schuppenhaare erkennbar sind, gedeihen in der Nebelwaldzone oder in der unteren Etage der tropischen Regenwälder.[3] Viele Taxa gedeihen in nährstoffarmen Habitaten.
Insgesamt gedeihen Bromelien-Arten in fast allen Landlebensräumen der Neotropis: Alle Wüstengebiete der Neuen Welt, sogar die trockenste Wüste der Welt, die Atacamawüste, zählen zu ihren Lebensräumen. Sie wachsen in felsigen Gebieten bis in Höhenlagen von über 4000 Metern. In den Páramo und auf den Tafelbergen, den Tepuis gedeihen viele Arten. Von den Tieflandregenwäldern, über die Bergwälder bis zu den Bergnebelwäldern und den Trockenwäldern und Dornwäldern findet man Arten, also in allen Waldformationen der Neotropis.[1]
Viele Arten bilden einen Blatttrichter aus, mit den Blattbasen bilden sie Zisternen, in denen sie Wasser sammeln können. Diese kleinen Teiche stellen eine eigene ökologische Nische dar (Biotop). Solche Lebensräume nennt man seit L. Varga 1928 Phytotelmata (Einzahl: Phytotelma).[7] Zum Beispiel leben einige tropische Baumfrosch-Arten (Hylidae) in Bromelien und pflanzen sich hier fort. Manchen Insekten-Arten dienen diese kleinen Teiche als Brutstätte für die Larven, und einige Wasserpflanzen leben darin.[8]
Einige wenige (3 von etwa 2900) Arten sind auf dem Weg der Evolution hin zu Fleischfressenden Pflanzen (Karnivoren), siehe Brocchinia oder Catopsis.
Die Bestäubung erfolgt meist durch Tiere, besonders Vögel (Ornithophilie) und Fledertiere (Chiropterophilie) oder auch durch Schmetterlinge (Lepidopterophilie). Bei vielen Arten wird in den Blüten viel Nektar produziert, solche Arten werden meist von Kolibris (Trochilophilie) bestäubt. Nur Navia-Arten sind windbestäubt (Anemophilie). Je nach Art sind die Blüten zu unterschiedlichen Tageszeiten geöffnet und bestäubungsfähig. Es gibt beispielsweise Arten, die nur nachts bestäubungsfähig sind, also besonders solche Arten, die durch Fledertiere oder Nachtfalter bestäubt werden; ihre Blüten sind oft weiß oder weißlich. Nur relativ wenige Arten besitzen duftende Blüten.
Vorkommen

Die ausschließlich neuweltliche Verbreitung (Neotropis) der Bromeliengewächse reicht in tropischen und subtropischen Gebieten von den südlichen Staaten der USA bis Südchile (44. Breitengrad) und auf die karibischen Inseln. Pitcairnia feliciana bildet die einzige Ausnahme mit ihrem kleinen Areal in Westafrika; man geht heute davon aus, dass sie durch Fernausbreitung nicht früher als vor 9,3 Millionen Jahren dort hingelangte, während man früher dieses Vorkommen als einen Beweis für die Kontinentaldrift (Raven & Axelrod 1974) mit heranzog (aus der nächsten Verwandtschaft den neotropischen Rapateaceae gibt es auch nur eine Art in Westafrika: Maschalocephalus dinklagei Gilg & K.Schum.).[3][9][10] Zentren der Artenvielfalt sind die Mata Atlântica in Brasilien, die Berghänge der Anden in Peru, Kolumbien und Ecuador, ebenfalls Mexiko und angrenzende Gebiete in Mittelamerika.
Bromelien-Arten sind in Höhenlagen zwischen der Tiefebene und der Páramo-Stufe (etwa 3200 bis 4500 Meter) beheimatet.[1]
Für einzelne Länder wurden 1991 und 1994 folgende Anzahlen von Bromelien-Arten ermittelt: Peru 411, Kolumbien 391, Ecuador 368, Venezuela 364, Bundesstaat Rio de Janeiro 311, Costa Rica 191, Florida 17. Die Diversitätszentren sind der Guayana-Schild und die Anden. Wobei die ursprünglichen Taxa fast nur auf dem Guayana-Schild vorkommen und dort wohl auch die Entwicklung alle Bromeliaceae begonnen hat. Die Tillandsioideae haben aber ihre größten Artenzahlen in den Anden und haben sich dort wohl auch entwickelt.[3] Für Mexiko ergaben sich 2004 folgende Informationen zur Artenvielfalt: Es gibt 18 Gattungen mit 342 Arten. Die beiden Ursulaea-Arten kommen nur in Mexiko vor. Die Gattung Hechtia besitzt in Mexiko ihr Zentrum der Artenvielfalt mit 49 der 51 bekannten Arten, wobei 46 davon nur in diesem Land vorkommen. Weitere Gattungen, die viele Arten in Mexiko aufweisen, sind Tillandsia mit 192 Arten und Pitcairnia mit 45 Arten. Die mexikanischen Bundesstaaten mit den meisten Arten sind Oaxaca (135 Arten), Chiapas (121 Arten), Veracruz (91 Arten), Guerrero (88 Arten), Jalisco (72 Arten) und Puebla (58 Arten).[11] Für Panama waren 2004 16 Gattungen mit 178 Arten nachgewiesen, wobei die artenreichsten Gattungen Guzmania (38 Arten), Werauhia (37 Arten), Tillandsia (34 Arten) und Pitcairnia (22 Arten) sind.[12] In Chile sind sechs Gattungen mit etwa 23 Arten, 2 Unterarten und 4 Varietäten heimisch, davon kommen 20 Arten nur dort vor,[13] einige Arten sind sehr selten und gefährdet.

Entwicklungsgeschichte
Es gibt nur wenige Fossilfunde aus der Verwandtschaft der Bromeliaceae. Am gesichertsten ist Karatophyllum bromelioides L.D.Gómez, ein von Luis Diego Gómez Pignataro 1972 beschriebenes 30 Millionen Jahre altes Fossil aus Sedimenten des Mittleren Tertiärs in Costa Rica.[14] Die ersten Bromeliaceae haben sich aus xerophytischen Arten im trockenen (ariden) Zentrum des Gondwana-Kontinentes entwickelt. Die Stammgruppe der Bromeliaceae datiert man etwa auf frühestens 112 Millionen Jahre vor heute, Wikström et al. 2001 vermuten das Alter der Stammgruppe bei 72 bis 69 Millionen Jahre vor heute. 84 und 23 Millionen Jahre vor heute vermutet man jeweils eine verstärkte adaptive Radiation ausgehend von den ursprünglichen Formen auf dem Guayana-Schild (Givnish u. a. 1997, 2004, 2008, 2011).
Systematik und botanische Geschichte
Botanische Geschichte
Charles Plumier benannte die Gattung Bromelia Plum. nach dem schwedischen Arzt und Botaniker Olaf Bromel (1639–1705). Antoine Laurent de Jussieu (Juss.) veröffentlichte die Familie Bromeliaceae 1789. Zuerst galt das alleinige Interesse (ab etwa 1690 in Europa) den Früchten der Ananas.
Christoph Kolumbus brachte bereits 1493 die Ananas (Ananas comosus) von seiner zweiten Reise zur Neuen Welt mit nach Spanien. Es dauerte jedoch bis 1776, dass eine zweite Art, Guzmania lingulata, nach Europa gebracht wurde. Aechmea fasciata kam 1828 und Lutheria splendens (früher Vriesea splendens) 1840 nach Europa. Als im 19. Jahrhundert exotische Pflanzen in Mode kamen, wurde mit der Kultur von Bromelien als Zierpflanzen begonnen.
Taxonomie
Die Familie Bromeliaceae wurde 1789 durch Antoine Laurent de Jussieu in Genera Plantarum, Seite 49–50 aufgestellt.[15] Synonyme für Bromeliaceae Juss. sind: Aechmeinae Wittmack, Billbergineae Wittmack, Bromelieae Wittmack.[15]
Innere Systematik
Zur Familie Bromeliaceae gehören 58 bis 73[16] Gattungen und etwa 2900 bis 3180 Arten.[17][10] Manche Bearbeiter sehen auch eine geringere Gattungsanzahl vor. Das Problem der Anzahl der Gattungen ergibt sich seit einiger Zeit besonders, weil durch genetische Stammbaumanalysen bestimmte Gruppen von Arten eindeutig nicht in die ursprüngliche Gattung passen. Beispiel dazu unter Tillandsioideae zu finden. Beispielsweise ist die Gattung Tillandsia im heutigen Umfang mit über 500 Arten polyphyletisch und so werden aktuell einzelne Gattungen ausgegliedert, dies ist „in Fluss“ und kann wohl derzeit nicht befriedigend dargestellt werden.
Bisher unterschieden die meisten Autoren drei Unterfamilien:
- Tillandsioideae Burnett: Wichtige Merkmale sind dreifächerige, septizide, trockene Kapselfrüchte und Samen mit fallschirmartigen Anhängseln. Es sind 1015 bis 1050 Arten enthalten. Es waren acht oder neun Gattungen und 2016 wurden insgesamt elf neue Gattungen aufgestellt.[16]
- Bromelioideae Burnett: Einzige Unterfamilie mit Beerenfrüchten und Samen ohne Anhängsel. Es sind 31 Gattungen und 722 bis 730 Arten enthalten.
- Pitcairnioideae Harms: Die Kapselfrüchte sind dreifächerig, septizid sowie trocken und die Samen sind meist geflügelt. Es ist eine bisher polyphyletische Gruppe. Die monophyletische Pitcairnioideae s. str. enthält heute nur noch fünf (Deuterocohnia, Dyckia, Encholirium, Fosterella und Pitcairnia) bis neun Gattungen und 465 bis 515 Arten. Aus dieser Unterfamilie Pitcairnioideae s. l. wurden die neuen Unterfamilien ausgegliedert.
Nach neuesten (2007 bis 2011) Untersuchungen kommen weitere Unterfamilien dazu, die alle in der bisher polyphyletischen Unterfamilie Pitcairnioideae zusammengefügt waren. Es ergeben sich damit insgesamt acht Unterfamilien:[18][10][15]
- Brocchinioideae (G.S.Varad. & Gilmartin) Givnish: Sie enthält nur eine Gattung:
- Brocchinia Schult.: Die etwa 21 Arten kommen im südlichen Venezuela und in Guyana vor.
- Hechtioideae Givnish: Sie enthält nur eine Gattung:
- Hechtia Klotzsch: Die etwa 60 Arten sind vom südlichen Texas bis nördlichen Nicaragua verbreitet; das Zentrum der Artenvielfalt ist mit 56 Arten Mexiko.
- Lindmanioideae Givnish: Sie enthält zwei Gattungen mit etwa 49 Arten:
- Connellia N.E.Br.: Die etwa sechs Arten kommen nur auf dem Guayana-Schild vom Ptari-Tepui bis Roraima-Tepui vor.
- Lindmania Mez: Die etwa 43 Arten sind vom nördlichen Südamerika bis ins nördliche Brasilien verbreitet.
- Navioideae Harms: Sie enthält vier oder fünf Gattungen mit etwa 110 Arten, alle Arten kommen nur auf dem Guayana-Hochland und im nordöstlichen Brasilien vor:
- Brewcaria L.B.Sm., Steyerm. & H.Rob.: Die etwa sechs Arten kommen im Guayana-Hochland im nordöstlichen Südamerika, nur in den Staaten Kolumbien und Venezuela vor.
- Sequencia Givnish: Eine 2007 neu aufgestellte Gattung mit der einzigen Art:
- Sequencia serrata (L.B.Sm.) Givnish (Syn.: Brocchinia serrata L.B.Sm.): Sie kommt in Kolumbien vor.
- Cottendorfia Schult. & Schult. f. in Roem. & Schult.: Sie enthält nur eine Art:
- Cottendorfia florida Schult. & Schult. f.: Sie kommt in Brasilien vor.
- Navia Mart. ex Schult. & Schult. f. in Roem. & Schult.: Ihre etwa 93 Arten haben Merkmale, die innerhalb der Bromeliaceae als die ursprünglichsten interpretiert werden. Als Besonderheit sind sie windbestäubt. Verbreitungsgebiet ist das nordöstliche Südamerika (Kolumbien, Venezuela, Brasilien, Guyana und Suriname) mit dem Guayana-Hochland als Entwicklungszentrum.
- Steyerbromelia L.B.Sm.: Die etwa sechs Arten kommen Guayana-Hochland im nordöstlichen Südamerika, nur in Venezuela vor.
- Puyoideae Givnish: Sie enthält nur eine Gattung:
- Puya Molina: Die etwa 200 bis 250 Arten sind auf dem südamerikanischen Kontinent verbreitet.
Der Stammbaum der Familie der Bromeliaceae mit seinen heute acht Unterfamilien:[19]
| Bromeliaceae |
| |||||||||||||||||||||||||||||||||||||||
Lange Zeit wurden in der Unterfamilie Pitcairnioideae alle Gattungen zusammengelegt, die weder zu den Tillandsioideae noch zu den Bromelioideae gehörten. Dabei war schon bekannt, dass das nicht die verwandtschaftlichen Verhältnisse widerspiegeln konnte und die Pitcairnioideae damit paraphyletisch waren. Trotzdem waren bisher nur die Bromelioideae und Tillandsioideae monophyletisch. Die neuesten Erkenntnisse dazu sind in T. J. Givnish et al. 2007 und 2011 veröffentlicht.[18][10]
Innerhalb der Ordnung der Poales sind die Bromeliaceae am nächsten mit den Typhaceae Juss. und diese beiden mit den Rapateaceae Dum. verwandt.
Ausbreitungsmechanismen und Vermehrungsmöglichkeiten in Kultur
Die Vermehrung erfolgt:
- generativ über:
- windverbreitete Samen oder
- Samen, die sich in Beeren befinden. Die Beeren werden von Tieren gefressen, die Samen werden dann unverdaut wieder ausgeschieden. Oder
- vegetativ durch auswachsende Seitensprosse, sie werden bei Bromelien Kindel genannt; bei manchen Arten entstehen die neuen Blattrosetten in einigem Abstand zur Mutterpflanze (Ableger).
Die Mutterpflanze stirbt nach der Samenbildung und der Bildung der Tochterpflanzen ab.
Besonders um eine hohe Vermehrungsrate bei nicht samenechten Hybriden zu erzielen werden bei einigen Sorten durch Methoden der pflanzlichen Gewebekultur In-vitro-Jungpflanzen in großen Mengen erzeugt.[20]
Verwendung und Inhaltsstoffe
Nur wenige Arten aus der Familie der Bromeliaceae werden vom Menschen als Nahrungsmittel oder zur Gewinnung von Fasern oder Wirkstoffen genutzt: Wirtschaftlich am stärksten genutzt werden die bekannten Ananas-Arten und ihre Sorten. Neben den Früchten liefern Ananas-Arten auch Fasern. Einige andere Bromelien-Arten werden auch zur Gewinnung von Fasern genutzt, wie zum Beispiel Neoglaziovia variegata (in Lateinamerika Caroa genannt). Aus Pflanzenteilen von Ananas-Arten wird das proteinspaltende (proteolytische) Enzym Bromelain isoliert, das dazu verwendet wird, um Fleisch zarter zu machen (es könnten auch andere Arten dazu verwendet werden, da Bromelaine in der Familie weit verbreitet sind). Tillandsia usneoides („Spanish Moss“) wird als Verpackungs- und Polstermaterial verwendet. Wenige Arten mit stark bewehrten Blättern werden als lebender „Stachelzaun“ angepflanzt (beispielsweise Arten der Gattung Bromelia).[1] Aus den Stämmen von Bromelia karatas und Bromelia laciniosa (in Brasilien Macambira genannt) wird nach Kochen und Sonnentrocknung ein Stärkepulver produziert. Von Greigia sphacelata werden die Früchte gegessen. Von Puya chilensis werden die knospigen Blütenstände als Salat gegessen, sie schmecken auch dem Brillenbären (Tremarctos ornatus); auch andere Pflanzenteile werden vom Menschen genutzt.[21]
Einige Arten und ihre Sorten sind beliebte, sehr lang blühende Zierpflanzen, die sich auch in Räumen als Zimmerpflanze gut pflegen lassen: Am häufigsten für den Verkauf kultiviert werden: Aechmea fasciata, einige Guzmania-Hybriden, einige Vriesea-Hybriden und Sorten von Vriesea splendens, Sorten von Ananas comosus und einige Tillandsien-Arten. Seltener im Handel zu finden sind wenige Neoregelia-Sorten, Billbergia-Sorten, Aechmea-Sorten, und viele andere. In tropischen und subtropischen Ländern zieren viele Arten und Sorten Parks, Gärten und Terrassen. Weltweit gesehen werden Frucht- oder Blütenstände selten als Schnittblumen angeboten; in den Ursprungsländern werden abgeschnittene Blütenstände etwas häufiger verwendet.[1]
Krankheiten
In Kultur können eine Reihe von Krankheiten auftreten.
Oft werden die jungen Pflanzen nach der Keimung und den ersten Monaten von „Vermehrungspilzen“ befallen und sterben frühzeitig ab. Colletotrichum crassipes kann auch an ausgewachsenen Pflanzen zu Blattfäulen führen. Besonders an Aechmea-Sorten kommt es oft zu Welkekrankheiten verursacht durch Fusarium- oder Verticillium-Arten. Dabei werden die Blätter erst gelb, dann ist auch die Sprossachse deutlich befallen und die Leitungsbahnen werden durch den Erreger verstopft und die Pflanze stirbt langsam ab.[1]
Eine Reihe von Läuse-Arten befallen die Bromelien: Blattläuse sind dabei relativ unproblematisch, Woll- und Schmierläuse sind schwerer zu bekämpfen. Verschiedene Schildlaus-Arten bilden verstärkt besonders in botanischen Sammlungen ein großes Problem. Oft spät entdeckt werden Wurzelläuse, die die Pflanzen schwächen. Zu erwähnen sind Spinnmilben und Trauermücken. Schnecken bilden höchstens an Aussaaten ein Problem.[1]
Vor Bekämpfungsmaßnahmen mit Pflanzenschutzmitteln ist eine fachkundige Beratung erforderlich und zu bedenken, dass viele Bromelien-Arten eine Reihe von Pflanzenschutzmitteln nicht vertragen; sie können beispielsweise zu großflächigen Nekrosen auf den Blättern führen.[1]
Quellen
- Eric J. Gouda, Derek Butcher, Leo Dijkgraaf: Encyclopaedia of Bromeliads. Version 5, 2023. (Abschnitte Beschreibung, Verbreitung und Systematik)
- Die Familie der Bromeliaceae bei der APWebsite. (Abschnitt Systematik)
- Die Familie der Bromeliaceae bei DELTA von L. Watson und M. J. Dallwitz.
- The Bromeliad Society International.
- Datenblatt Bromeliad Biota der University of Florida. „Bromelien als Lebensraum für andere Organismen“.
Literatur
- Werner Rauh: Bromelien – Tillandsien und andere kulturwürdige Bromelien. Verlag Eugen Ulmer, Stuttgart 1990, ISBN 3-8001-6371-3 (Abschnitt Verbreitung, Ökologie und Beschreibung)
- Harry E. Luther: An Alphabetical List of Bromeliad Binomials. 2008, (PDF; 321 kB) In: The Marie Selby Botanical Gardens. Sarasota, Florida, USA. Veröffentlicht durch The Bromeliad Society International. (PDF-Datei; 314 kB)
- Harry E. Luther, Gregory K. Brown: Bromeliaceae. - textgleich online wie gedrucktes Werk, In: Flora of North America Editorial Committee (Hrsg.): Flora of North America North of Mexico. Volume 22: Magnoliophyta: Alismatidae, Arecidae, Commelinidae (in part), and Zingiberidae. Oxford University Press, New York/ Oxford 2000, ISBN 0-19-513729-9. (Abschnitt Beschreibung)
- Ralf Horres: Untersuchungen zur Systematik und Phylogenie der Bromeliaceae unter besonderer Berücksichtigung molekularer Merkmale. Dissertation zur Erlangung des Doktorgrades
der Naturwissenschaften beim Fachbereich Biologie der Johann Wolfgang Goethe-Universität in Frankfurt am Main, 2003. (PDF; 2,5 MB)
- Thomas J. Givnish, Kendra C. Millam, T. M. Evans, J. C. Pires, Paul E. Berry, Kenneth J. Sytsma: Phylogeny, biogeography, and ecological evolution in Bromeliaceae-insights from ndhF sequences. In: J. T. Columbus, E. A. Friar, J. M. Porter, L. M. Prince, M. G. Simpson: Monocots: Comparative Biology and Evolution. Poales. Aliso. Volume 23, 2007, S. 3–26. (PDF-Online) (Abschnitt Systematik)
- David H. Benzing, Bradley C. Bennett, Gregory K. Brown, Mark A. Dimmitt, Harry E. Luther, Ivón M. Ramirez, Randall G. Terry, Walter Till: Bromeliaceae: Profile of an Adaptive Radiation. Cambridge University Press, 2000, ISBN 0-521-43031-3. (Google-Book Online-Version) (Abschnitte Verbreitung und Evolution)
- Georg Zizka, Marco Schmidt, Katharina Schulte, Patricio Novoa, Raquel Pinto, Konstantin König: Chilean Bromeliaceae: diversity, distribution and evaluation of conservation status. In: Biodiversity and Conservation. 18, 9, 2009, S. 2449–2471. doi:10.1007/s10531-009-9601-y (Abschnitt Verbreitung)
- Thomas J. Givnish, Michael H. J. Barfuss, Benjamin Van Ee, Ricarda Riina, Katharina Schulte, Ralf Horres, Philip A. Gonsiska, Rachel S. Jabaily, Darren M. Crayn, J. Andrew C. Smith, Klaus Winter, Gregory K. Brown, Timothy M. Evans, Bruce K. Holst, Harry Luther, Walter Till, Georg Zizka, Paul E. Berry, Kenneth J. Sytsma: Phylogeny, adaptive radiation, and historical biogeography in Bromeliaceae: Insights from an eight-locus plastid phylogeny. In: American Journal of Botany. Volume 98, 2011, S. 872–895. PDF. doi:10.3732/ajb.1000059
- Eric J. Gouda, Derek Butcher: A List of Accepted Bromeliaceae Names. University Botanic Gardens, Utrecht online.
Einzelnachweise
- Werner Rauh: Bromelien - Tillandsien und andere kulturwürdige Bromelien. Verlag Eugen Ulmer, Stuttgart 1990, ISBN 3-8001-6371-3.
- Ralf Horres: Untersuchungen zur Systematik und Phylogenie der Bromeliaceae unter besonderer Berücksichtigung molekularer Merkmale. Dissertation zur Erlangung des Doktorgrades der Naturwissenschaften beim Fachbereich Biologie der Johann Wolfgang Goethe-Universität in Frankfurt am Main, 2003. (PDF; 2,5 MB)
- David H. Benzing, Bradley C. Bennett, Gregory K. Brown, Mark A. Dimmitt, Harry E. Luther, Ivón M. Ramirez, Randall G. Terry, Walter Till: Bromeliaceae: Profile of an Adaptive Radiation. Cambridge University Press, 2000, ISBN 0-521-43031-3. (Google-Book Online-Version)
- Abbildungen zu den Schuppenhaaren.
- Ana Lúcia Pires Cotias-de-Oliveira, José Geraldo Aquino de Assis, Moema Cortizo Bellintani, Jorge Clarêncio Souza Andrade, Maria Lenise Silva Guedes: Chromosome numbers in Bromeliaceae. In: Genetics and Molecular Biology. Volume 23, 1, 2000, S. 173–177. (PDF, 594 kB)
- J. Gitaí, Ralf Horres, A. M. Benko-Iseppon: Chromosomal features and evolution of Bromeliaceae. In: Plant Systematics and Evolution. Volume 253, Springer Wien, 2005, S. 65–80.
- L. Varga: Ein interessanter Biotop der Biocönose von Wasserorganismen. In: Biologisches Centralblatt, Band 48, 1928, S. 143–162.
- B. A. Richardson: The bromeliad microcosm and the assessment of faunal diversity in a Neotropical forest. In: Biotropica. Volume 31, 1999, S. 321–336.
- Thomas J. Givnish, Kendra C. Millam, T. M. Evans, J. C. Hall, J. C. Pires, Paul E. Berry, Kenneth J. Sytsma: Ancient vicariance or recent long-distance dispersal? Inferences about phylogeny and South American-African disjunctions in Rapateaceae and Bromeliaceae based on ndhF sequence data. In: International Journal of Plant Sciences. Volume 165, 2004, S. 35–54. doi:10.1086/421067
- Thomas J. Givnish, M. H. J. Barfuss, B. Van Ee, R. Riina, Katharina Schulte, Ralf Horres, P. A. Gonsiska, R. S. Jabaily, D. M. Crayn, J. A. C. Smith, K. Winter, Gregory K. Brown, T. M. Evans, Bruce K. Holst, Harry E. Luther, Walter Till, Georg Zizka, P. E. Berry, Kenneth J. Sytsma: Adaptive radiation and diversification in Bromeliaceae: insights from a 7-locus plastid phylogeny. In: American Journal of Botany. Volume 98, Issue 5, 2011, S. 872–895. PDF. doi:10.3732/ajb.1000059
- Adolfo Espejo-Serna, Ana Rosa López-Ferrari, Ivón Ramírez-Morillo, Bruce K. Holst, Harry E. Luther, Walter Till: Checklist of Mexican Bromeliaceae with Notes on Species Distribution and Levels of Endemism. In: Selbyana. 2004, Volume 25. Issue 1, S. 33–86. (Volltext-PDF) JSTOR:41760147
- Daniel Cáceres González, Katharina Schulte, Marco Schmidt, Georg Zizka: A synopsis of the Bromeliaceae of Panama, including new records for the country. In: Willdenowia. Volume 41, 2011, S. 357–369. DOI:10.3372/wi.41.41216
- Georg Zizka, Marco Schmidt, Katharina Schulte, Patricio Novoa, Raquel Pinto, Konstantin König: Chilean Bromeliaceae: diversity, distribution and evaluation of conservation status. In: Biodivers. & Conservation. Volume 18, Issue 9, 2009, S. 2449–2471. (Volltext-PDF)
- Karatophyllum bromelioides L.D.Gómez (Bromeliaceae), nov. gen. et sp., del Terciario Medio de Costa Rica. In: Revista de Biología Tropical. Volume 20, Issue 2, 1972, S. 221–229: (PDF, 969 kB)
- Eric J. Gouda, Derek Butcher, Leo Dijkgraaf: Encyclopaedia of Bromeliads. Version 5, 2023. zuletzt eingesehen am 1. Januar 2024
- Michael H. J. Barfuss, Walter Till, Elton J.C. Leme, Juan P. Pinzón, José M. Manzanares, Heidemarie Halbritter, Rosabelle Samuel, Greg K. Brown: Taxonomic revision of Bromeliaceae subfam. Tillandsioideae based on a multi-locus DNA sequence phylogeny and morphology. In: Phytotaxa, Volume 279, Issue 1, Oktober 2016, S. 001–097. doi:10.11646/phytotaxa.279.1.1
- Harry E. Luther: An Alphabetical List of Bromeliad Binomials. 2008. (PDF; 321 kB) In: The Marie Selby Botanical Gardens. Sarasota, Florida, USA. Veröffentlicht durch The Bromeliad Society International.
- Thomas J. Givnish, J. C. Pires, S. W. Graham, M. A. McPherson, L. M. Prince, T. B. Patterson: Phylogeny, biogeography, and ecological evolution in Bromeliaceae: Insights from ndhF sequences. In: J. T. Columbus, E. A. Friar, J. M. Porter, L. M. Prince, M. G. Simpson: Monocots: Comparative Biology and Evolution. Poales. Rancho Santa Ana Botanical Garden, Claremont, 2007, 23, S. 3–26.
- Die Familie der Bromeliaceae bei der APWebsite.
- H. Mercier, G. B. Kerbauy: Bromeliaceae. In: Y. P. S. Bajaj: High-tech and micropropagation. Volume VI, Springer, 1997, ISBN 3-540-61607-1, S. 43–57. Google-Book.
- Einträge zu Bromeliaceae bei Plants For A Future
Weiterführende Literatur
- Lyman B. Smith, Robert Jack Downs: Flora Neotropica. Volume 14, No. 1: Pitcairnioideae (Bromeliaceae). 1974, Hafner Press, New York, USA, ISBN 0-89327-303-1.
- Lyman B. Smith, Robert Jack Downs: Flora Neotropica. Volume 14, No. 2: Tillandsioideae (Bromeliaceae). 1977, Hafner Press, New York, USA, ISBN 0-02-852520-5.
- Lyman B. Smith, Robert Jack Downs: Flora Neotropica. Volume 14, No. 3: Bromelioideae (Bromeliaceae). 1979, The New York Botanical Garden, New York, USA, ISBN 0-89327-210-8.
- Eric Gouda: Studies on the flora of the Guianas no. 90: Checklist of Bromeliaceae of the Guianas with notes on critical species. In: Selbyana, Volume 20, 1, 1999, S. 30–39. Volltext online.
- Darren M. Crayn, Klaus Winter, J. Andrew C. Smith: Multiple origins of crassulacean acid metabolism and the epiphytic habit in the Neotropical family Bromeliaceae. In: Proceedings of National Academy of Sciences. Volume 101, No. 10, 2004, S. 3703–3708. Volltext-PDF.
- Katharina Schulte, Georg Zizka: Auf der Suche nach der „Ur-Bromelie“ – basale Verwandtschaftskreise innerhalb der Bromeliaceae. In: Die Bromelie. 2007, 3, S. 158–162.
- Thorsten Krömer, M. Kessler, G. Lohaus, Alexander N. Schmidt-Lebuhn: Nectar sugar composition in relation to pollination syndromes in Bromeliaceae. In: Plant Biology. Volume 10, Issue 4, 2008, S. 502–511.
- Gustavo Q. Romero, Fausto Nomura, Ana Z. Gonçalves, Natacha Y. N. Dias, Helenice Mercier, Elenice de C. Conforto & Denise de C. Rossa-Feres: Nitrogen fluxes from treefrogs to tank epiphytic bromeliads: an isotopic and physiological approach. In: Oecologia. Volume 162, Issue 4, 2010, S. 941–949.
- Ivan M. Quezada, Ernesto Gianoli: Crassulacean acid metabolism photosynthesis in Bromeliaceae: an evolutionary key innovation. In: Biological Journal of the Linnean Society. Volume 104, Issue 2, 2011, S. 480–486. doi:10.1111/j.1095-8312.2011.01713.x
- Timothy M. Evans, Rachel S. Jabaily, Ana Paula Gelli de Faria, Leandro de Oliveira F. de Sousa, Tania Wendt, Gregory K. Brown: Phylogenetic Relationships in Bromeliaceae Subfamily Bromelioideae based on Chloroplast DNA Sequence Data In: Systematic Botany, Volume 40, Issue 1, 2015, S. 116–128. doi:10.1600/036364415X686413
- Ingeborg M. Niesler: Gescannte Bromelien – ein Farbrausch! In: Die Bromelie, 2016 (1), 2016, S. 4–14. Englisch: Scanned Bromeliads – a Flash of Colours! cover.
- Jamie Males, Yasmin Baksh-Comeau, Dan Jaggernauth, Shane Ballah, Shahada Paltoo, Howard Griffiths: Epiphytic CAM Bromeliads indicate vulnerability of tropical forest communities to climate change. In: Annals of Botany, mcad152, 2023. doi:10.1093/aob/mcad152
- David H. Benzing: Bromeliaceae: A Brief Profile and some Topics that Warrant Further Consideration. In: Selbyana, Volume 34, September 2023, S. 1–79. Volltext-PDF.
Weblinks
- Tom Deutschle: Faszination Regenwald - Bromelien.
- Peter v. Sengbusch: Botanik Online - Schuppenhaare der Bromelien.
- Derek Butcher: Key to the genera of the Bromeliaceae. 2004. (online)