Alkoholaminierung
Die Alkoholaminierung ist ein chemisch-technisches Verfahren und die heutzutage bedeutendste Methode zur Herstellung von niederen aliphatischen Aminen. Grundprinzip dieser Reaktion ist die katalytische Aminierung von Alkoholen mit Ammoniak, sowie primären oder sekundären Aminen, zu einem Produktgemisch aus Mono-, Di- und Trialkylaminen. Neben gewöhnlichen Alkoholen werden nach dieser Technologie auch höher funktionalisierte Verbindungen wie z. B. Aminoalkohole, Polyole, Fettalkohole sowie Polyetherole aminiert.
Verfahrensvarianten
Die aliphatischen Amine zählen zu den wichtigsten organischen Zwischenprodukten der Chemischen Industrie. Besonders kurzkettige Amine werden vor allem durch die Alkoholaminierung in verschiedenen Verfahrensvarianten hergestellt. Letztere unterscheiden sich vor allem in der Art des Katalysators, der Temperatur- und Druckbereiche sowie die Art der Durchführung (Gas- oder Flüssigphase). Diese Bedingungen hängen insbesondere von den physikalischen und chemischen Eigenschaften der eingesetzten Alkohole ab. Die folgende Tabelle zeigt eine Übersicht der verschiedenen Verfahrensvarianten:
| Verfahrensvariante | Ausführung | Temperatur (°C) | Druck (bar) | Katalysator | Produkte |
|---|---|---|---|---|---|
| Aminierung kurzkettiger Alkohole C1 | Gasphase ohne H2 | 250–450 | 10–40 | Saure Mischoxide von Si, Al, Ti, W, Zeolithe | Methylamine |
| Aminierung kurzkettiger Alkohole C2–C6 | Gas-/Flüssigphase mit H2 | 150–250 | 30–80 | Metalloxide von Ni, Cu, Co, Fe, Ru, Re | Alkylamine C2–C6 |
| Aminierung langkettiger Alkohole C8–C15 | Flüssigphase mit H2 | 180–250 | 180–300 | Metalloxide von Ni, Cu, Co, Fe, Ru, Re | Fettamine C8–C15 |
| Aminierung von Aminoalkoholen | Flüssigphase mit H2 | 140–230 | 150–250 | Metalloxide von Ni, Cu, Co, Fe, Ru, Re | Ethylenamine, Propylenamine etc. |
Verfahrensübersicht
Die Umsetzung der Alkohole mit Ammoniak wird – je nach Alkohol – in der Gas- oder Flüssigphase an sauren oxidischen Katalysatoren oder an Übergangsmetalloxid-Katalysatoren mit Dehydrier- und Hydrierfunktionen, meist in Gegenwart von Wasserstoff, durchgeführt. Dabei entsteht immer ein Produktgemisch aus primären, sekundären und tertiären Aminen. Formal ergibt sich folgende Gleichung als Übersichtsreaktion:
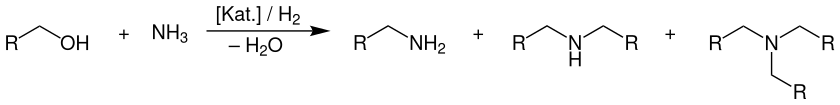
Als Katalysatoren werden vornehmlich Übergangsmetalloxide (bevorzugt Nickel-, Kupfer- und Cobaltoxid) auf einem oxidischen Trägermaterial (Al2O3, SiO2, TiO2, ZrO2) sowie saure Mischoxidkatalysatoren auf Basis von Aluminium und Silicium (Alumosilikate, Zeolithe) eingesetzt. Letztere sind jedoch auf die Synthese der Methylamine aus Methanol beschränkt, da ab einem Alkylrest von zwei Kohlenstoffatomen, die Dehydratisierung der eingesetzten Alkohole zum entsprechenden Alken zunehmend als Konkurrenz- und Nebenreaktion eintritt. Folglich verwendet man in diesen Fällen Übergangsmetalloxide als Katalysator, die sowohl eine Dehydrierung, als auch eine Hydrierung ermöglichen. Weitere Details werden im Abschnitt Reaktionsmechanismus genauer erläutert. Weiterhin wird die Reaktion in Gegenwart von Wasserstoff (außer bei den Methylaminen) durchgeführt. Dieser sorgt dafür, dass etwaige Nebenreaktionen wie die Imid- oder Nitrilbildung zurückgedrängt werden und bewahrt den Katalysator vor möglicher Deaktivierung durch Ablagerungen von stickstoff- oder kohlenstoffhaltigen Verkokungsprodukten.
Reaktionsmechanismus
Bezüglich der Untersuchung des Mechanismus der Alkoholaminierung wurden in den vergangenen Jahren zahlreiche mechanistische Studien durchgeführt. Dabei kamen verschiedene Arbeitsgruppen zu unterschiedlichen Ergebnissen. Die heutzutage verbreitetste Annahme über den korrekten Reaktionsmechanismus wurde bereits von Schwoegler und Adkins (1939) erkannt und durch weitere Untersuchungen im Wesentlichen bekräftigt.
Gemäß diesem Mechanismus wird zunächst in dem geschwindigkeitsbestimmenden Schritt der Alkohol durch den Übergangsmetalloxid-Katalysator zur entsprechenden Carbonylverbindung (Aldehyd bzw. Keton) dehydriert (1). An diese lagert sich dann nucleophil Ammoniak unter Bildung eines Halbaminals (2) als Zwischenstufe an. Über einen Übergangszustand wird Wasser eliminiert und ein Imin (3) bzw. Enamin (4) gebildet, welche durch die Imin-Enamin-Tautomerie im Gleichgewicht stehen. In einem letzten Schritt wird das Imin/Enamin dann wieder am Katalysator zum entsprechenden Amin (5) hydriert.[1]

In dem Übersichtsschema wurde die Aminierung eines primären Alkohols erläutert, lässt sich aber analog auf sekundäre Alkohole übertragen. Tertiäre Alkohole können nicht durch dieses Verfahren in Amine überführt werden, da eine Oxidation (Dehydrierung) zu den entsprechenden Carbonylverbindungen nicht möglich ist. Ebenfalls kann mit diesem Mechanismus nicht die Bildung des tertiären Alkylamins erklärt werden, da sekundäre Amine mit Carbonylverbindungen keine Imine bilden können. Nach der Vorstellung von Baiker et al. (1983) kann die Bildung des Trialkylamins erklärt werden, wenn ein über das Stickstoffatom adsorbierte sekundäre Amin mit einem an der Katalysatoroberfläche adsorbierten Alkohol-Molekül reagiert. Dieser Zwischenschritt findet bei der Dehydrierung des Alkohols zur Carbonylverbindung durch eine α-H-Abstraktion statt.[2]
Verfahrensbeschreibung
Bei der technischen Herstellung der C2–C6-Alkylamine durch Aminierung kurzkettiger Alkohole wird Ammoniak, der entsprechende Alkohol und gegebenenfalls Wasserstoff über einen Verdampfer (1), den Wärmetauscher (Vorwärmer) (2) und einen Überhitzer (3) in einen Festbettreaktor gefahren. In den meisten Fällen ist dieser Reaktor als Rohr- oder Rohrbündelreaktor ausgelegt. Nach der Reaktion wird der gasförmige Produktstrom, bestehend aus Ammoniak, Wasserstoff, Prozesswasser und den Alkylaminen (Mono-, Di- und Trialkylamin) über den Wärmetauscher (2) in einen Kühler (4) geleitet und anschließend im Trenngefäß (5) von gasförmigen Wasserstoff befreit. Letzterer wird wieder zur Reaktionsstufe zurückgeführt. Anschließend gelangt der flüssige Produktstrom in den Sumpf der Ammoniak-Kolonne (6), in der Ammoniak über Kopf abgetrennt wird und zur gemeinsam mit dem Wasserstoff zur Reaktionsstufe zurückgeführt wird. Der Sumpf der Kolonne wird nun in die Monoalkylamin-Kolonne (7), in der das niedrig siedende Monoalkylamin abgetrennt wird, geleitet. Das verbleibende Produktgemisch aus Di- und Trialkylamin sowie Wasser, wird in der Dialkylamin-Kolonne (8) weiter aufgetrennt und das Dialkylamin über Kopf abgezogen. In einem letzten Schritt wird das Prozesswasser in einen Separator (9) entfernt und das Trialkylamin in der Trocknungskolonne (10) von restlichem Wasser befreit.
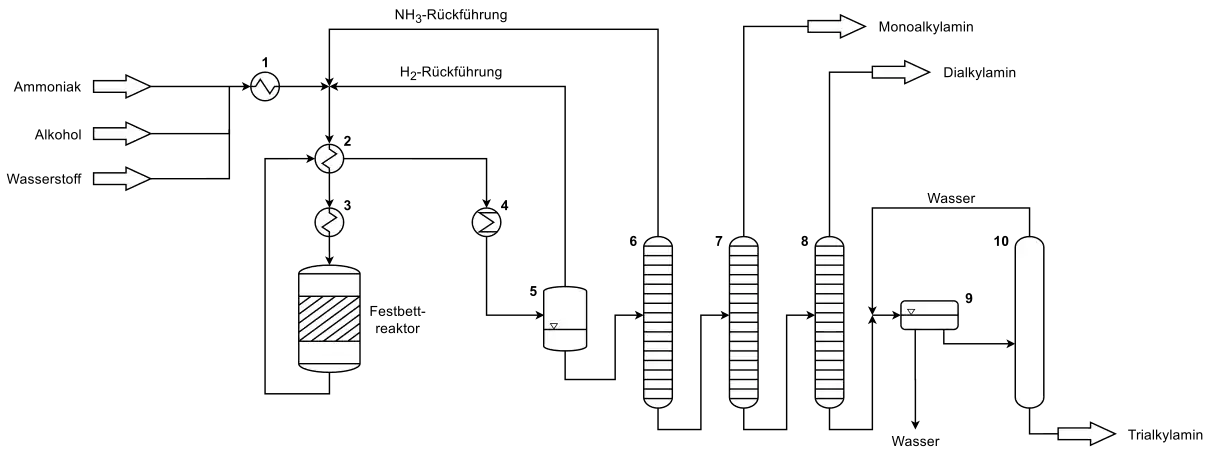
Das dargestellte Verfahrensfließbild zeigt dabei ein vereinfachtes Schema für die Durchführung der Reaktion in der Gasphase.
Literatur
- Roland Dittmeyer, Wilhelm Keim, Gerhard Kreysa, Alfred Oberholz (Hrsg.): Winnacker • Küchler: Chemische Technik – Prozesse und Produkte – Organische Zwischenverbindungen, Polymere. 5. Auflage. Band 5. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2005, ISBN 978-3-527-30770-8.
Einzelnachweise
- Peter Roose, Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke: Amines, Aliphatic. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, 30. September 2015, doi:10.1002/14356007.a02_001.pub2.
- Andreas Karl Rausch: Heterogen-katalysierte Hydroaminierung von Ethanol. Carl von Ossietzky Universität Oldenburg, Diplomarbeit, S. 13, (Link).