Albinismus
Albinismus (von lateinisch albus ‚weiß‘[1]) ist eine Sammelbezeichnung für angeborene Störungen in der Biosynthese der Melanine (das sind Pigmente, also Farbstoffe), die sich auf die daraus resultierende hellere Haut-, Haar- bzw. Fellfarbe und Augenfarbe, aber auch auf andere Merkmale auswirken (Polyphänie). Betroffene Tiere nennt man Albinos, betroffene Menschen ziehen meist die neutralere Bezeichnung „Menschen mit Albinismus“ vor. Menschen mit Albinismus bekommen leichter Sonnenbrand und deshalb auch leichter Hautkrebs. Außerdem sind bei vollständigem Albinismus Sehschärfe und räumliches Sehen eingeschränkt. Vereinzelt findet sich auch die Bezeichnung Noach-Syndrom.[2]
| Klassifikation nach ICD-10 | |
|---|---|
| E70.3 | Albinismus |
| ICD-10 online (WHO-Version 2019) | |


Albinismus folgt grundsätzlich einem rezessiven Erbgang und kommt beim Menschen weltweit mit einer durchschnittlichen Häufigkeit (Prävalenz) von 1:20.000 vor. Häufungen finden sich vor allem in Afrika mit einer Prävalenz von 1:10.000 und höher. Die helle Hautfarbe der Asiaten und Europäer ist auf Albinismus vom Typ OCA 4 zurückzuführen, die blonden Haare und blauen Augen der Europäer auf OCA 2 und ein weiteres Gen.
Bei Säugetieren einschließlich des Menschen tritt der Albinismus mit aufgehellter Augen-, Haut- und Haar- bzw. Fellfarbe aus denselben Gründen auf, da bei ihnen die Farbstoffsynthese sehr ähnlich ist. Bei anderen Tiergruppen gibt es neben den Melaninen noch andere Farbstoffe und die Verwendung des Begriffes Albinismus ist dort uneinheitlich. Bei Vögeln entstehen blaue und grüne Farben sowie schillernde Farbspiele durch Federstrukturen in Verbindung mit Melanin. Gelbe, orange und rote Farben gehen meist auf Carotinoide und Pteridine zurück. Bei Reptilien, Amphibien und Fischen entstehen grüne und blaue Farben, ein silbriger Schimmer oder metallischer Glanz durch Purine, die Licht reflektieren. All diese Farbstoffe können durch Mutationen ausfallen.
Albinismus beim Menschen
Erscheinungsbild und Symptome
Selbst Menschen, deren Körper überhaupt kein Melanin produzieren kann, die also vollständig albinotisch sind, fallen in Mittel- und Nordeuropa nicht extrem auf, da hier durch teilweisen Albinismus aufgehellte Haut, Haare und Augen als Anpassung an die geringere Sonneneinstrahlung der Normalfall sind. Vollständiger Albinismus führt beim Menschen zu rosa Haut, weißblonden Haaren und rosa-blauen Augen. Menschen mit schwächer ausgeprägtem Albinismus sind an ihrem Äußeren nicht immer eindeutig als solche zu erkennen. Sie sehen zwar heller aus als Familienmitglieder ohne Albinismus, doch meist ist noch eine Restfunktion der Melaninproduktion erhalten, sodass es auch Dunkelhäutige mit Albinismus gibt, die deutlich braune Haut und hellbraune Augen haben.
Während die meisten Menschen mit Albinismus eine hellere Augen- und Haarfarbe haben als ihre nicht albinotischen Blutsverwandten (okulokutaner Albinismus, OCA),[4] gibt es auch Fälle von Albinismus, bei denen sich die Symptomatik allein auf die Augenschäden beschränkt, während sie äußerlich normal aussehen (okulärer Albinismus, OA).
Hautfarbe
Menschen mit Albinismus haben aufgehellte Haut. Sie bekommen leichter Sonnenbrand und haben dadurch ein höheres Hautkrebsrisiko. Die Hautfarbe der Weißen wird als Anpassung an die geringere Sonneneinstrahlung außerhalb der Tropen unter anderem durch Mutationen der Albinismusgene aufgehellt, jedoch nicht in dem Maße, dass dadurch erkennbare Augenschäden entstehen.[5][6][7][8]
Das Sehen betreffende Symptome
Beim rein okulären Albinismus und bei allen Formen des vollständigen oder fast vollständigen okulokutanen Albinismus liegt ein ausgeprägter Symptomkomplex an den Augen vor. Die Farbwahrnehmung ist jedoch normal, da Albinismus keinen Einfluss auf die Bildung des Rhodopsins hat.
Aufhellung der Augenfarbe
Die menschlichen Augenfarben der Iris können unterschiedlich sein von Dunkelbraun über Hellbraun und Grün bis zu Grau und Blau oder falls die Iris pigmentlos ist, rot erscheinen, da die blutroten Gefäße durchscheinen.
Albinismus bewirkt eine hellere Augenfarbe. Vollständiger Albinismus führt unabhängig davon, welche Augenfarbe der Betreffende ohne seinen Albinismus hätte, zu hellblauen, fast rosa Augen wie oben im Bild zu sehen, was beim Menschen aber sehr selten vorkommt. Wenn sehr wenig Melanin produziert wird, sind die Augen blau. Liegt schwächer ausgeprägter Albinismus vor, bei dem der Körper noch merkliche Mengen an Melanin erzeugen kann, sind die Augen entsprechend weniger hell gefärbt.
Lichtempfindlichkeit

Wenn der Körper kaum oder nahezu kein Melanin produzieren kann und es deshalb im Auge nicht oder in nur sehr geringem Maße vorhanden ist, wird die Iris in gewissem Umfang transparent und mit entsprechendem Licht durchleuchtbar. Bei geringer ausgeprägten Fällen finden sich die Pigmentdefekte dann eher im Bereich der Iriswurzel. Diese Transparenz zeigt sich auch beim Hineinleuchten in das Auge durch rote Lichtreflexe. Typisch für Menschen mit hochgradigem Albinismus ist deshalb eine ausgeprägte Blendungsempfindlichkeit (Photophobie), weshalb sie im Freien meist eine Sonnenbrille tragen.
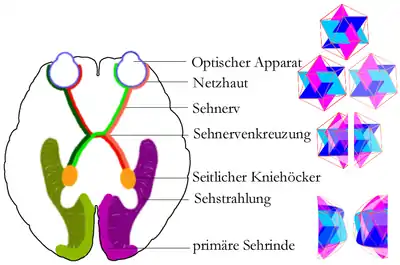
Störungen des räumlichen Sehens
Melanin spielt auch bei der Entwicklung der Sehnerven eine Rolle. Normalerweise ist das Gesichtsfeld beim Menschen unter beiden Gehirnhälften gleichmäßig aufgeteilt – jede Gehirnhälfte hat ihre Seite und bekommt von beiden Augen den Teil des Bildes geliefert, der zu dieser Seite gehört (Sehbahn). Durch den Vergleich beider Bilder kann jede Gehirnhälfte die Entfernung der Gegenstände berechnen und räumlich zuordnen (stereoskopisches Sehen). Bei Menschen mit Albinismus kreuzt ein größerer Anteil der Sehnerven zur gegenüberliegenden Gehirnhälfte, wodurch ein Verlust der physiologischen Nachbarschaft homologer Netzhautareale eintritt und zusammengehörige Bilder nicht immer auf derselben Seite verarbeitet werden.
Zudem liegt in der Regel ein okulärer Nystagmus (Augenzittern) von unterschiedlichem Schweregrad vor, häufig einhergehend mit manifestem Strabismus (Schielen). Bei einer Untersuchungsreihe von 37 Patienten hatten alle einen Nystagmus verschiedener Ausprägung, nur vier von ihnen schielten nicht.[9] Die genannten Umstände haben deshalb häufig ein fehlendes oder zumindest deutlich eingeschränktes räumliches Sehen zur Folge.
Verminderte Sehschärfe
Die Sehgrube (Fovea centralis), die Netzhautstelle des schärfsten Sehens, ist beim Albinismus anatomisch nicht voll ausgebildet, da ihre Entwicklung ebenfalls durch Melanin beeinflusst wird. Sie wird entweder nicht ausgebildet (Aplasie) oder entwickelt sich nur unvollständig (Hypoplasie) als Foveahypoplasie.[9]
Bedingt durch den Nystagmus und die organische Situation beträgt der Visus (Sehschärfe) bei einem voll ausgeprägten Albinismus selten mehr als 0,1, eher weniger, und kann bei geringerem Schweregrad der Anomalie bis etwa 0,5 erreichen.[9] Die Sehbehinderung schwankt auch innerhalb des gleichen Typs teils stark. Wegen der bestehenden Pigmentdefekte der Iris sind Kontraste zwischen hellen und dunklen Stellen im Raum häufig nur undeutlich zu erkennen.
Außerdem sind Menschen mit Albinismus oft nicht in der Lage, das Auge auf unterschiedliche Entfernungen scharf einzustellen (Akkommodation), und viele Betroffene sind kurz- oder weitsichtig.
Das Hören betreffende Symptome
Sehr selten ist das Albinismus-Taubheit-Syndrom.
Behandlung

Albinismus hat keinen Einfluss auf die geistige Entwicklung von Menschen. Deshalb können sie meist, trotz des nicht therapierbaren Stoffwechseldefekts, mit Hilfe von (vergrößernden) Sehhilfen, getönten Brillen oder Kontaktlinsen und entsprechendem Hautschutz ein weitgehend normales Leben führen.

Melaninsynthese
Der Farbstoff Melanin wird von farbstoffbildenden Zellen, den Melanozyten, produziert. Die Vorstufen der Melanozyten des Embryos, die Melanoblasten, wandern während der Schwangerschaft in der frühen Fötalperiode aus der Neuralleiste in die Epidermis der Haut, in die Haarfollikel und verschiedene andere Organe aus. In der Haut angelangt, differenzieren sich die Melanoblasten zu Melanozyten und bilden zahlreiche Zellfortsätze aus, über die sie das Melanin an die Keratinozyten weitergeben. Die Menge der Melanozyten ist bei Schwarzen dieselbe wie bei Weißen und auch ein an Albinismus Erkrankter hat normal viele Melanozyten. Die Hautfarbe wird durch die Menge und Qualität des gebildeten Farbstoffs Melanin bestimmt, nicht durch die Anzahl dieser Zellen.
Melanozyten enthalten Melanosomen, kleine membranumschlossene Bläschen, in denen der Farbstoff Melanin produziert wird. Sie sind in ihrer Funktion den Lysosomen (Zellorganellen, die der Verdauung innerhalb der Zelle dienen) sehr ähnlich, denn beide enthalten Stoffe, die für die Zelle gefährlich sind und deshalb nicht mit dem Rest der Zelle in Berührung kommen dürfen. Die Lysosomen beinhalten eiweißauflösende Enzyme (Proteasen) und die Melanosomen enthalten Zwischenprodukte der Melaninsynthese wie Chinone und Phenole, welche die Membranen der Zelle beschädigen können.
Um Melanin zu produzieren, werden diverse Enzyme gebraucht, die nacheinander beim Aufbau des Melanins mitwirken (Genwirkkette). Wenn eines der Enzyme dieses Stoffwechselwegs nicht mehr funktionsfähig ist, tritt Albinismus auf. Die Eumelaninbildung in den Melanosomen beginnt mit einer Hydroxylierung der Aminosäure (AS) L-Tyrosin durch das membranständige Enzym Tyrosinase. Neben diesem Schlüsselenzym sind zwei weitere ebenfalls membranständige Enzyme DHICA-Oxidase und Dct erforderlich, damit Eumelanin gebildet werden kann.
Molekulargenetische Klassifizierung des Albinismus
Obwohl Unterschiede im Aussehen der Menschen mit Albinismus schon früh beschrieben wurden, ging man davon aus, dass Albinismus auf die Veränderungen in einem einzigen Gen zurückzuführen ist. Erst die von Trevor-Roper im Jahre 1952 beschriebene Familie, bei der beide Eltern von Albinismus betroffen waren und dennoch normal pigmentierte Kinder hatten, gab einen ersten Hinweis auf die genetische Heterogenität dieser Erkrankung. Beide Eltern waren in diesem Fall homozygot (reinerbig) für Genmutationen, die zum Albinismus führten. Diese betrafen jedoch unterschiedliche Gene, so dass die Kinder für jede der beiden Mutationen heterozygot (mischerbig) waren und somit klinisch nicht von Albinismus betroffen waren.
Zuerst klassifizierte man Albinismus nach dem äußeren Erscheinungsbild. Später konnte man nachweisen, ob Tyrosinase – ein zur Melaninproduktion nötiges Enzym – vorhanden war. Mit der Möglichkeit der Identifizierung einiger verantwortlicher Gene für den OCA etablierte sich schließlich eine molekulargenetische Klassifikation. Man stellte fest, dass die unterschiedlichen Phänotypen nicht immer auf Mutationen in unterschiedlichen Genen zurückzuführen sind, sondern oft unterschiedliche Ausprägungen diverser Mutationen in einem Gen darstellen. Die klinische Differenzierung bleibt schwierig, da nicht vom Aussehen (Phänotyp) auf die verursachende Mutation (Genotyp) geschlossen werden kann.
Es sind vier Typen des Okulokutanen Albinismus bekannt. Oculo-cutan setzt sich zusammen aus (lat.) oculus: Auge und cutaneus: die Haut betreffend. Beim Okulären Albinismus sind nur die Augen sichtlich verändert.
| Albinismustyp | Gen | Genprodukt | Funktion | Chromosom | Erscheinungsbild | Gesundheit |
|---|---|---|---|---|---|---|
| Okulokutaner Albinismus Typ 1, abgekürzt OCA 1 | TYR | Tyrosinase | Enzym bei Synthese von Melanin | Chromosom 11 (11q14-21) |
OCA1A: Vollständiger Albinismus, rosa Haut, die nicht bräunt, hellblaue Augen mit rosa Schimmer OCA1B: unvollständiger Albinismus |
OCA1A: Sehbehinderung mit einem Visus unter 10 % OCA1B: Sehbehinderung variabel, Visus unter 10 % bis nicht erkennbar |
| Okulokutaner Albinismus Typ 2, abgekürzt OCA 2 | OCA2 | P-Protein, ein Membranprotein des Endoplasmatischen Reticulums | Transport der Tyrosinase aus dem Endoplasmatischen Reticulum heraus | Chromosom 15 (15q11-13) | Verantwortlich für blondes Haar und blaue Augen bei Europäern
OCA2: variabel: vollständiger Albinismus bis zu kaum sichtbare Aufhellung, teilweise mit dunklen Nävi (Leberflecken, Muttermale) auf der hellen Haut |
Europäer: gesund, keine erkennbare Sehbehinderung
OCA2: Sehbehinderung variabel Manchmal mit Prader-Willi-Syndrom (PWS) oder Angelman-Syndrom vergesellschaftet, da die Genorte beider Erbkrankheiten nebeneinander liegen. |
| Okulokutaner Albinismus Typ 3, abgekürzt OCA 3 | TYRP1 | (TYRP1) | DHICA-Oxidase, DHICA-Polymerase | Chromosom 9 (9p23) | Bei Schwarzen: braune oder rotbraune Haut, braune Haare, grünbraune bis braune Augen | keine erkennbare Sehbehinderung |
| Okulokutaner Albinismus Typ 4, abgekürzt OCA 4 | SLC45A2 | MATP | Transporter für die Proteine der Melanozyten | Chromosom 5 (5p13.3) | helle Haut bei Europäern und Asiaten
vollständiger Albinismus bis nur leichte Aufhellung, eventuell Nävi |
Europäer, Asiaten: keine Sehbehinderung erkennbar
OCA4: Sehbehinderung variabel |
| Okulärer Albinismus Typ 1, abgekürzt OA 1 | GPR143 | G-Protein-gekoppelter Rezeptor 143 | Regulation der Entstehung der Melanosomen und ihres Transportes | X-Chromosom Xp22.3-p22.2 | Haut normal dunkel, Augen aufgehellt | Riesenmelanosomen, Sehbehinderung |
Bei der Maus sind bisher über 100 Gene bekannt, die die Fell- und Augenfarbe beeinflussen. Daher ist davon auszugehen, dass es auch im menschlichen Genom noch einige bisher unbekannte Gene gibt, die die Pigmentierung beeinflussen.[10]
Syndrome, die mit Albinismus verbunden sind
Während die meisten Menschen mit Albinismus nur eine hellere Haut und bei vollständigem Albinismus eine Sehbehinderung haben, gibt es einige Erbkrankheiten, bei denen der Albinismus von weiteren Krankheitssymptomen begleitet wird.
Zwei Syndrome sind oft mit OCA 2 verbunden: das Prader-Willi-Syndrom (PWS) und das Angelman-Syndrom. Beide beruhen auf Mutation auf dem langen Arm von Chromosom 15, wo auch das P-Gen liegt, das für OCA 2 verantwortlich ist, und sind dann mit Albinismus verbunden, wenn eine Mutation sich über beide Gene hinweg erstreckt.
Beim Hermansky-Pudlak-Syndrom, dem Griscelli-Syndrom und dem Chediak-Higashi-Syndrom (CHS) sind Gene mutiert, die neben den Melanosomen auch andere Organellen wie Lysosomen oder Zentriolen beeinflussen. Dadurch treten zusätzliche Krankheitszeichen auf.
| Syndrom | verantwortliches Gen | Genprodukt | Funktion | Chromosom (Genlocus) | Erscheinungsbild | Gesundheit |
|---|---|---|---|---|---|---|
| Prader-Willi-Syndrom kombiniert mit OCA2 | P-Gen
und väterliches Gen HBII-52 fehlend oder funktionsuntüchtig oder mütterliches doppelt[11][12] |
P-Protein und eine kleine im Zellkern codierte RNA (snoRNA) HBII-52 | HBII-52: Diese snoRNA reguliert die prä-mRNA-Prozessierung einer mRNA vom Gen des Serotonin Receptor 2C, das auf einem anderen Chromosom liegt. Durch die Mutationen entstehen abweichende Genprodukte dieses anderen Gens.[11] | Chromosom 15 (15q11-13)[12] | Oculocutaner Albinismus Typ 2[13] sowie Fettsucht, kleine Statur und kleine Hände und Füße und ein charakteristisch verändertes Gesicht[12] | Sehbehinderung durch Albinismus[13] sowie verringerte Kindsbewegungen, Muskelhypotonie, Trinkschwäche des Neugeborenen, später Esssucht, verringerte Ausbildung der Geschlechtsorgane und geringe bis mäßige geistige Behinderung.[12] |
| Angelman-Syndrom kombiniert mit OCA2[14] | P-Gen
und Mutationen von UBE3A[15] |
P-Protein E6-AP Ubiquitin Ligase | Die E6-AP Ubiquitin Ligase ist die E3-Ligase in dem Reaktionweg, in dem Proteine mit Ubiquitin markiert werden, um deren Halbwertszeit, Funktion oder Verteilung innerhalb der Zelle zu regulieren. Daneben ist es ein Transkriptions-Koaktivator.[16] | Chromosom 15 (15q11-13) | Oculocutaner Albinismus Typ 2, kleiner Kopf (Mikrozephalie), Wachstumsstörungen, häufig Wirbelsäulenverkrümmung (Skoliose) in der Pubertät, kleine Hände und Füße, nach außen gedrehte Füße, großer Mund mit hervorstehendem Oberkiefer, kleine Zähne | häufiges Lachen, psychische und motorische Entwicklungsverzögerungen, kognitive Behinderung, Hyperaktivität und stark reduzierte Lautsprachentwicklung |
| Hermansky-Pudlak-Syndrom (HPS) | HPS1, AP3B1, HPS3, HPS4, HPS5, HPS6, DTNBP1, BLOC1S3[17] | Verschiedene Untereinheiten der Proteine BLOC1, BLOC2, BLOC3, BLOC4, BLOC5, sowie AP3 | Diese Proteine werden zum Aufbau, zur Reifung und zum Transport von Organellen benötigt, die zum endosomal-lysosomalen System gehören. Dazu zählen Lysosomen, Melanosomen und die Serotoningranula (δ-Granula) der Thrombozyten, das sind Organellen, die bei der Aggregation von Thrombozyten eine Rolle spielen.[18][19][20][21][22][23][24][25] | Chromosom 11 (11p15-p13), Chromosom 10 (10q24.32, 10q23.1), Chromosom 6 (6p22.3), Chromosom 3 (3q24), Chromosom 22 (22q11.2-q12.2), Chromosom 19 (19q13),[17] Chromosom 5 (5q14.1)[19] | Albinismus | Ablagerung von Ceroid in den Lysosomen, den Melanozyten und den Serotoningranula, Sehbehinderung, erhöhte Blutungsneigung, Lungenfibrose |
| Griscelli-Syndrom
Es gibt drei Varianten des Syndroms: Griscelli-Syndrome Typ 1 (GS1)[26] Griscelli-Syndrome Typ 2 (GS2)[26] Griscelli-Syndrome Typ 3 (GS3)[26] |
GS1: MYO5A[26] | Myosin 5A ist ein Motorprotein[29]
RAB27A zählt zu den Rab-Proteinen, die als molekulare Schalter fungieren, die den interzellulären Vesikeltransport regulieren.[30] MLPH ist nötig, damit Myosin 5A RAB27A erkennt und Melanosomen statt anderer Organellen transportiert.[31] |
Myosin 5A arbeitet mit Rab27a beim Transport verschiedener Organellen innerhalb der Zelle zusammen. Dazu zählen die Melanosomen. Myosin 5A ist bei der Zellteilung in der Teilungsspindel zu finden und transportiert dort wahrscheinlich die Centriolen. Bei Ausfall des Gens halbiert sich die Zellteilungsrate.[29]
Zum Transfer der Melanosomes aus dem Zellinneren in der Nähe des Zellkernes zu den weiter außen gelegenen Aktinfilamenten sind RAB27A, Melanophilin und Myosin 5A nötig.[30] MLPH ist nötig, damit Myosin 5A RAB27A erkennt und Melanosomen statt anderer Organellen transportiert.[31] |
Myosin 5A und RAB27A: Chromosom 15 (15q21)[26][27]
MLPH: Chromosom 2 (2q37)[28] |
silber-graues Haar | Immundefekte. Krankheitsschübe mit Fieber und Eindringen von Lymphozyten in Organe führen zu Lebervergrößerung, Erkrankungen der Lymphknoten, starker Verminderung aller Blutzellen und unterschiedlichen, sich dauernd verstärkenden Erkrankungen des Nervensystems. Wird die Erkrankung nicht behandelt, verläuft sie tödlich.[32][33]
GS1: hauptsächliche Manifestation im Nervensystem ohne Schwäche des Immunsystems und ohne Eindringen der Lymphozyten in Organe.[26] GS2: mit immunologischer Manifestation[26] GS3: ohne immunologische oder neurologische Manifestation.[26] |
| Chediak-Higashi-Syndrom | LYST[34] | Lyst-Protein | Verteilung von Proteinen zu ihren Zielorten beispielsweise in Endosomen[34] | Chromosom 1 (1q42.1–q42.2) | silbrig-blondes Haar | Hepatosplenomegalie, Ganglion-Hypertrophie und rezidivierende eitrige Infektionen der Haut und der Atemwege. |
Ferner gibt es das seltene Tietz-Syndrom.
Begriffsgeschichte
Nachschlagewerke des 19. Jahrhunderts nennen unter anderem die Bezeichnungen Kakerlakismus, Leukosis, Leucaethiopia und Leucopathia congenita für den Albinismus. Betroffene Menschen wurden unter anderem als „Kakerlak(en)“ „Albinos“ (aus dem Spanischen), als „Blafards“ (aus dem Französischen) und als „weiße Neger“ bezeichnet.[35] Die offenbar von Holländern auf Java geprägte Bezeichnung „Kakerlak“ soll auf die Lichtscheuheit der Betroffenen zurückgehen (in Analogie zur Lichtscheuheit der Küchenschabe) und ist pejorativ.[36][37] Der Begriff des Albinismus setzte sich durch.
Umgang mit der Sehbehinderung
Die Sehbehinderung schwankt auch innerhalb des gleichen Typs stark. Bei voll ausgeprägtem Albinismus ist eine Sehschärfe lediglich bis etwa 0,1 (ungefähr 10 Prozent im Vergleich zum Normalsichtigen) erreichbar, bei sehr geringer Ausprägung bis etwa 0,5. Damit kann man, solange die Verkehrssituation übersichtlich ist, Fahrrad fahren, übersieht aber oft selbst so große Dinge wie die Stangen am Eingang eines Fußgängerweges, die Autos den Zugang verwehren sollen. Autofahren ist deshalb nur in wenigen Ländern mit vielen Einschränkungen erlaubt. Gesichter zu erkennen ist aus einer Entfernung von mehreren Metern unmöglich, dafür werden oft die Gangart oder prägnante Kleidungsstücke erkannt. Zum Lesen muss der Text meist deutlich vergrößert werden.
Diskriminierung und Ermordung
Wie alle Menschen, die andersartig sind, haben Menschen mit Albinismus ein erhöhtes Risiko, ausgegrenzt und diskriminiert zu werden.[38] Bei hellhäutigen Völkern ist diese Gefahr geringer, da die äußerlichen Unterschiede weniger auffallend und teilweise kaum zu erkennen sind. Bei dunkelhäutigen Völkern sind die Unterschiede auffälliger, und Ausgrenzung ist deshalb häufiger.
Oft stehen Menschen mit Albinismus in Verruf, Unglück zu bringen (wie etwa im Sudan oder in Mali); siehe zu diesem Thema auch die Biografie des Musikers Salif Keïta. In Tansania, dem Land mit der wohl höchsten Albino-Rate der Welt,[39] ist hingegen in jüngerer Zeit der Aberglaube aufgekommen, dass Albinos glücksbringende Kräfte besäßen. 2007 sollen daher 20 Menschen mit Albinismus von „witch doctors“ getötet worden sein, um aus ihren Körperteilen Zaubermittel herzustellen, die zu Reichtum verhelfen sollen.[40] Von März bis November 2008 waren es sogar 36 Menschen mit Albinismus in Tansania und im benachbarten Burundi, die aus diesem Grund getötet wurden.[41] Die tansanische Regierung hat Hexern ein Betätigungsverbot erteilt und eine Aufklärungskampagne gestartet, die Polizei hat für das Auffinden einer im November 2014 verschwundenen 4-Jährigen eine Belohnung ausgesetzt. Seit 2000 wurden in Tansania mindestens 74 Menschen mit Albinismus, darunter zahlreiche Kinder, ermordet.[42][43]
2008 wurde über Morde aus Kenia, der Demokratischen Republik Kongo und Eswatini berichtet.[44][45] In Malawi wurden nach Angaben von Amnesty International von 2014 bis 2016 mindestens 18 Menschen mit Albinismus getötet.[46] Die Albinism Foundation of Zambia AFZ berichtet u. a. aktuell über den letzten Mord im März 2020.[47]
In Simbabwe und Sambia dient der Aberglaube, Geschlechtsverkehr mit Albinos würde eine HIV-Infektion heilen, als Vorwand, Frauen mit Albinismus zu vergewaltigen.[48] Im Jahr 2018 wurde in Simbabwe als Gegenreaktion eine „Miss Albino“ gewählt.[49]
Tag der Aufklärung über Albinismus
Nach einer UN-Menschenrechtsrat-Resolution vom 13. Juni 2013 berichteten die Vereinten Nationen (UN) über Angriffe und Diskriminierung gegenüber Menschen mit Albinismus. Daraufhin erklärte die Generalversammlung am 18. Dezember 2014 den 13. Juni, den Tag der Resolution des Menschenrechtsrats, zum Internationalen Tag der Aufklärung über Albinismus.[50]
Nutzung des auffälligen Erscheinungsbildes in Kunst, Musik und Schaustellerei

Filme, Bücher und Computerspiele tragen teilweise zur Diskriminierung bei. In ihnen wird albinotischen Menschen oft die Rolle des Bösen bzw. des Bösewichts zugeschrieben, wie beispielsweise der stehlende, brandschatzende, mordende Wissenschaftler Griffin in H. G. Wells Roman Der Unsichtbare (1887) oder der mordende Mönch Silas in The Da Vinci Code – Sakrileg. Im Film Powder besitzt der Protagonist zwar besondere Fähigkeiten, die er als „gottgegeben“ annimmt, muss aber trotzdem um soziale Akzeptanz kämpfen. Als weiteres Beispiel dient die Figur Elric von Melniboné, des Hauptdarstellers des gleichnamigen Romans von Michael Moorcock.
Menschen mit Albinismus traten oft im Zirkus auf oder wurden gegen Bezahlung ausgestellt. Einerseits stellte das für die Betroffenen eine Möglichkeit dar, ihren Lebensunterhalt zu bestreiten, andererseits wurden dadurch auch falsche Vorstellungen verbreitet. So arbeiteten Rudolph Lucasie und seine Familie drei Jahre lang als lebende Kuriositäten im „American Museum on Broadway“. Sie wurden in dieser Ausstellung fälschlicherweise als Menschen dargestellt, die mit offenen Augen schlafen.[51]
Das auffällige Erscheinungsbild des Albinismus kann in künstlerischen Berufen durchaus für den beruflichen Erfolg genutzt werden, ohne direkt thematisiert zu werden. Beispiele für Sänger mit Albinismus sind Edgar und Johnny Winter, Yellowman und Salif Keïta.
Albinismus bei anderen Säugetieren



Bei Säugetieren sind die genetischen Ursachen und gesundheitlichen Folgen von Albinismus ebenso gelagert wie beim Menschen, der ja zu ihnen zählt. Albinismus-Mutationen sind üblicherweise in jeder Art einzeln entstanden, betreffen aber Gene, die den menschlichen Albinismusgenen sehr ähnlich sind.[52][53]
Unterschiede gibt es aber in den Bezeichnungen in Humanmedizin und Zoologie: Bei Säugetieren wird die Bezeichnung Albino oft ausschließlich für Tiere mit OCA1 verwendet, bei denen keine Restfunktion der Tyrosinase erhalten ist und die deshalb weißes Fell, rosa Haut und rote Augen haben. Das ist verwirrend, da beim Menschen zusätzlich zu allen Mutationen des Tyrosinasegens auch alle anderen Störungen der Melaninsynthese als Albinismus bezeichnet werden, Syndrome, die bei Tieren sehr unterschiedliche Namen haben.[52]
- Okulokutaner Albinismus Typ 1 entspricht bei den meisten Säugetieren dem Albino-Locus.[52]
- Okulokutaner Albinismus Typ 2 entspricht bei Säugetieren der Rosa-Augen-Serie (pink eye dilution P).[52]
- Okulokutaner Albinismus Typ 3 heißt bei Säugetieren meist Braun-Locus (B).[52]
- Okulokutaner Albinismus Typ 4 hat keinen einheitlichen Namen. Das Gen heißt etwa beim Pferd Cream-Gen.[54]
- Okulärer Albinismus Typ 1.
Die einzelnen bekannten Mutationen sind auch dort besprochen.
Als Dilute-Gen werden eine Reihe verschiedener Gene bezeichnet, die zu einer Farbaufhellung führen und meist durch Gene des Albinismusspektrum verursacht werden:[52]
- Das Myosin-5a-Gen führt zu aufgehellter Fellfarbe und mit dem Griscelly-Syndrom verwandten Krankheitszeichen.
- MLPH ist ein Gen, das ebenso wie Myosin 5a beim Transport der Melanosomen eine Rolle spielt. Es führt aus sehr ähnlichen Gründen wie dieses zu einer Aufhellung der Fellfarbe; einige Mutationen des Gens bewirken zusätzlich Haarausfall.
- Das Gen für die Fellfarbe Champagne des Pferdes ist eine Mutation des SLC36A1-Gens (Solute Carrier 36 family A1), das auch PAT1 (proton/amino acid transporter 1) oder LYAAT1 (lysosomal amino acid transporter 1) genannt wird. Es gehört zur selben Genfamilie wie das Gen, das Okulokutanen Albinismus Typ 4 hervorruft.[55]
- Eine Mutation des Gens SLC45A5 ist verantwortlich für die Golden (gol) dilution genannte Mutation der Maus.[55]
Der Silver-Locus beeinflusst ebenfalls die Farbsynthese, mit dem Ergebnis, dass die Melanozyten vorzeitig absterben, und führt zudem bei mehreren betroffenen Arten zu Taubheit und Missbildungen der Augen. Insgesamt ähneln die Symptome also eher dem Leuzismus, obwohl es sich um eine Variante des Albinismus handelt.
Auch bei Tieren gibt es weitere noch nicht identifizierte Gene, die zu teilweisem oder vollständigem Albinismus führen.[52]
Dem Chédiak-Higashi-Syndrom (CHS) und dem Hermansky-Pudlak-Syndrom (HPS) vergleichbare Krankheiten gibt es bei der Maus, beim Aleutennerz, der Perserkatze, beim Rind, beim Schwein, bei der Ratte, beim Fuchs und selbst beim Schwertwal.[52]
Auch die zyklische Hämatopoese des Hundes ähnelt diesen Syndromen. Betroffene Tiere sind silbergrau, die Zahl der neutrophilen Granulozyten ist periodisch verringert, ebenso die der roten Blutkörperchen (Erythrozytopenie) und der Blutplättchen (Thrombozytopenie). Das führt zu einer Blutgerinnungsstörung und erhöhter Infektanfälligkeit. Meist sterben die Tiere kurz nach der Geburt.[52]
Albinismus bei Vögeln




Neben Melaninen spielen bei Vögeln noch Carotinoide und Federstrukturen bei der Entstehung der Farben eine Rolle.[56]
Wie bei Säugetieren entstehen bei Vögeln schwarze und braune Farben durch Eumelanin und Phäomelanin. Dieselben Gene wie bei Säugetieren können deshalb auch bei Vögeln zu weißer oder aufgehellter Farbe führen.[56]
Carotinoide werden mit der Nahrung aufgenommen und führen zu roten, orangen und gelben Farbtönen. Vögel, bei denen Carotinoide an der Entstehung der Farben beteiligt sind, sind beispielsweise die Schafstelze (Motacilla flava), der Fitis (Phylloscopus trochilus), die Blaumeise (Cyanistes caeruleus), die Kohlmeise (Parus major) und der Pirol (Oriolus oriolus). Dagegen ist die rote Brust des Rotkehlchens (Erithacus rubecula) durch Phäomelanin verursacht. Wenn die Nahrung zu wenig Carotine enthält, sind die entsprechenden Federbereiche nach der nächsten Mauser weiß. Mutationen, die zu Störungen der Carotinoidanreicherung in den Feder führen, sind selten.[56]
Sowohl schillernde als auch nicht schillernde blaue und grüne Farben entstehen bei Vögeln meist durch die Struktur der Melanosomen. Das Melanin ist regelmäßig in Stäbchen, Blättchen, Röhren oder anderen Strukturen angeordnet. Die Dicke und Anordnung der Schichten verstärkt selektiv die sichtbare Lichtfarbe nach dem Prinzip der Interferenz an dünnen Plättchen. Fehlt durch Albinismus das Melanin, wird durch die Struktur der Anordnung immer noch dieselbe Farbe selektiv verstärkt, die anderen Wellenlängen werden jedoch nicht durch Melanin ausgefiltert, sodass der Vogel insgesamt dennoch weiß wirkt, manchmal ist ein grüner oder blauer Schimmer wahrnehmbar, wo er sonst blau oder grün wäre.[57][58][59]
Störungen der Farbstoffsynthese bei Fischen, Amphibien und Reptilien
Bei Fischen, Amphibien und Reptilien entsteht die Farbe von Haut und Schuppen dadurch, dass Licht mit drei verschiedenen Typen von Chromatophoren (Pigmentzellen, Farbstoffbildende Zellen) interagiert: den Melanophoren, Xanthophoren und Iridophoren.[10][60][61]
Diese drei Zelltypen, die die Farbe von Haut und Schuppen beeinflussen, sind miteinander verwandt. Deshalb gibt es einige Mutationen, die die Produktion aller drei Farbstoffe verhindern. Darüber hinaus kommen Mutationen, die die Farbstoffproduktion in Melanophoren und Xanthophoren verhindern, aber Iridophoren nicht beeinflussen. Umgekehrt gibt es auch Mutationen, die die Farbstoffproduktion in Iridophoren und Xanthophoren verhindern, aber Melanophoren nicht beeinflussen. Außerdem gibt es auch Mutationen, die nur einen der drei Farbstofftypen beeinflussen.[60]
Amelanismus
.JPG.webp)
Die Melanophoren entsprechen in ihrer Funktion den Melanozyten der Säugetiere. Sie enthalten Melanosomen mit Melanin als Farbstoff. In den meisten Fällen wird nur ein Melanintyp synthetisiert, nämlich Eumelanin. Als Amelanismus bezeichnet man Melaninbildungsstörungen. Manchmal wird Amelanismus fälschlicherweise mit Albinismus gleichgestellt, Albinismus ist jedoch nicht auf Amelanismus beschränkt, sondern meint auch das Fehlen anderer Pigmente als Melanin.[62] Da Melanin bei allen Tieren im Wesentlichen denselben Syntheseweg hat, führen Mutationen der den Albinismusloci der Säugetiere entsprechenden Gene auch bei Fischen, Amphibien und Reptilien zu Amelanismus.[60][10] [63] [64] [65] [66] [67]
Mangel an Iridophorenfarbstoffen
Die Iridophoren enthalten „reflecting platelets“, die Purine produzieren. Die kristallisierten Purine rufen durch Reflexion unterschiedliche Farbeindrücke hervor, häufig grün, blau oder ein irisierendes Glitzern. Sie sind für den silbrigen Schimmer oder metallischen Glanz bei Fischen verantwortlich.[60]
Axanthismus
Die Xanthophoren enthalten Pterinosomen, die Pteridine und Flavine sowie aus der Nahrung aufgenommene Carotine enthalten. All diese Farbstoffe sind für gelbliche oder rote Farben verantwortlich. Fallen diese Farbstoffe aus, bleibt nur derjenige Teil der Farbe erhalten, der durch Melanine und Purine erzeugt wird. Dieser Zustand wird Axanthismus genannt.[60][61][10][68]
Beispiele
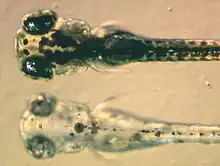
Beim Zebrabärbling sind Larven mit der Mutation „sandy“, die keinerlei Melanin produzieren können, aus unbekannten Gründen völlig blind, obwohl Linse und Retina abgesehen vom Mangel an Melanin normal entwickelt zu sein scheinen. Die erwachsenen Fische sind, wie bei vollständigem Albinismus zu erwarten, stark sehbehindert und zeigen eine ausgeprägte Lichtscheu. Weitere Mutationen mit den Namen Golden, Albino, Brass und Mustard führen ebenfalls zu unterschiedlich stark ausgeprägtem Albinismus, ihre Larven sind jedoch nicht blind.[69]
Da bei Fischen alle Fasern der Sehnerven zur anderen Seite herüberkreuzen und nicht wie bei Säugetieren nur ein Teil, kann die Sehnervenkreuzung nicht durch Melanin beeinflusst werden.[60]
Der Leopardgecko (Eublepharis macularius) hat drei unabhängig voneinander entstandene Mutationen, die dazu führen, dass kein oder weniger Melanin produziert wird (Amelanismus). Auf englisch heißen sie „Tremper albino“, „Rainwater albino“ und „Bell albino“. Kreuzt man Tiere mit einer dieser Mutationen mit Tieren, die eine andere dieser Mutationen haben, entstehen normalfarbige Nachkommen.[10]
Syndrome bei Fischen, Amphibien und Reptilien, die mit Albinismus verbunden sind
Die Mutante „bleached blond“ des Zebrabärblings hat eine Mutation in einem Gen, das den Teil Ac45 der ATP-Synthase herstellt. Als Embryos erscheinen sie, abgesehen von ihrer aufgehellten Farbe, völlig normal. Die meisten Larven mit dieser Mutation entwickeln aber während des weiteren Wachstums keine Schwimmblase und gedeihen nicht so recht, auch wenn sie einige Tage überleben können.[70]
Störungen der Farbstoffsynthese bei Gliederfüßern
Melanin bei Gliederfüßern
Auch bei vielen Gliederfüßern (Arthropoda) trägt Melanin zur Farbgebung bei. Daneben spielt Melanin auch eine Rolle bei der Aushärtung der Cuticula (der harten Außenhaut) vieler Gliederfüßer und bei ihrer unspezifischen Immunabwehr gegen verschiedene Mikroorganismen. Eine Überproduktion von Melaninen ist jedoch für die Tiere selbst tödlich, so dass die Melaninproduktion sehr genau gesteuert werden muss.[71][72]
Augenfarbe der Insekten: Ommatochrome und Pteridine

Die Ommatochrome sind Farbstoffe, die in den Augen von Insekten auftreten, zu denen Xanthommatin, Ommine und Ommidine zählen. Bei einigen Gruppen haben sich zusätzliche Funktionen dieser Farbstoffe evoluiert, wie beispielsweise die Colorierung der Außenhülle und die Ausscheidung von Tryptophan. Die Funktion der Ommatochrome bei der Färbung von Schmetterlingsflügeln geht offensichtlich auf eine einzige Mutation in der Familie der Edelfalter (Nymphalidae) zurück.[73][74]
Im Insektenauge kommen wie in den Xanthophoren der Amphibien, Reptilien und Fische auch verschiedene Pteridine vor. Bei der Schwarzbäuchigen Taufliege (Drosophila melanogaster) sind das beispielsweise Isoxanthopterin, Pterin, Biopterin, Sepiapterin und Drosopterine. Ihre Biosynthese beginnt mit der Umwandlung von Guanosintriphosphat in Dihydroneopterin und spaltet sich danach in verschiedene Synthesewege für die einzelnen Pteridine auf.[74]
Viele verschiedene Mutationen beeinflussen die Augenfarbe von Insekten, indem sie ihre Synthese verhindern oder den Transport der verschiedenen Vorstufen für Pteridine oder Ommatochrome verhindern.[74]
Augenfarben der schwarzbäuchigen Taufliege (Drosophila melanogaster)
Die Gene White, Brown und Scarlet von der Schwarzbäuchigen Taufliege (Drosophila melanogaster), die auch als Fruchtfliege bekannt ist, codieren Proteine, die zu den ABC-Transportern zählen. Die Genprodukte des White-, Brown-Gens arbeiten bei der Produktion eines Membranproteins zusammen, das Guanin durch die Zellmembran transportiert. White und Scarlet arbeiten bei der Herstellung eines Tryptophan-Transporters zusammen.[75]
Es gibt fünf Allele des White-Gens, die zu aufgehellter Augenfarbe führen. Bei zweien (w(crr) (H298N) und w(101) (G243S)) ist die Menge der roten (Pteridin) und braunen (Xanthommatin) Farbstoffe gleichermaßen sehr stark verringert, da beide Transporter gleichermaßen betroffen sind. Bei einer weiteren Mutation (w(Et87)) ist die Aufhellung beider Farben nur gering. Bei zwei weiteren Mutationen (w(cf) (G589E) und w(sat) (F590G)) ist besonders die Produktion der roten Farbstoffe betroffen, da hauptsächlich die Wirksamkeit des Guanin-Transporters durch die Mutation beeinflusst wird.[75]
Das Scarlet-Gen beeinflusst vor allem die Menge des produzierten Xanthommatins. Einige der Mutationen führen zu einer temperaturabhängigen Farbstoffproduktion, wie man es bei Säugetieren für die Colorpoint-Mutationen kennt.[76]
Soziale Folgen von Albinismus für Tiere
Auch viele soziale Tiere grenzen abweichend aussehende oder sich ungewöhnlich verhaltende Artgenossen so aus, wie wir es von Menschen kennen.[77]
Die mit Albinismus oder Leuzismus verbundene größere Zahmheit der Tiere bietet in Menschenobhut einen erheblichen Überlebensvorteil: Sie macht es Menschen leichter, eine Beziehung zu den Tieren aufzubauen. Albino-Mäuse bringen ihre Jungtiere häufiger und zuverlässiger in das Nest zurück.
Tiere mit Albinismus sind oft Publikumslieblinge in Zoos.
Selektion

Fehlende Tarnung, eingeschränktes Sehvermögen und höhere Lichtempfindlichkeit können durch Albinismus hervorgerufene Selektionsnachteile sein. Bei Mäusen wurden eine deutlich verminderte Laufleistung und weniger Aktivität in offenem Gelände festgestellt.

Ganz anders ist die Situation in Menschenobhut: Da die Tiere von ihren Besitzern beschützt und mit Futter versorgt werden, ist die weiße Farbe für das Überleben unerheblich.
Bei Tieren, die ihr gesamtes Leben in Höhlen verbringen wie der Blinde Höhlensalmler (Astyanax mexicanus), hat die Tarnfarbe keine Funktion mehr, da dort kein Licht ist, in dem man die Farbe wahrnehmen könnte. Inzwischen sind von über 80 Fischarten weiße Höhlenformen bekannt.[78][79]
Daneben hat weiße Fellfarbe aber auch einen Selektionsvorteil. Dunkles Fell sendet stärker polarisiertes Licht aus als weißes, und da Insekten fähig sind, polarisiertes und unpolarisiertes Licht voneinander zu unterscheiden und durch polarisiertes Licht angezogen werden, werden weiße Tiere weniger von Bremsen belästigt als dunkle. Sie können deshalb ungestörter fressen und haben ein geringeres Risiko, von durch Insekten übertragenen Krankheiten befallen zu werden.[80]
Xanthismus und Albinismus sind unklar definiert
Unklar definiert sind folgende Begriffe:
- Xanthismus: gelbe oder orange Tiere. Je nach natürlicher Farbe der Art müssen dabei entweder Melanine und Puridine in der Haut fehlen oder nur eines von beiden. Hinzu kommt, dass beim Menschen der Okulokutane Albinismus Typ 3 (OCA 3) früher ebenfalls als Xanthismus bezeichnet wurde.
- Albinismus hat drei verschiedene Bedeutungen:
- nur Melanin fällt ganz oder teilweise aus,[10][68]
- ein weißes Tier durch vollständigen Ausfall sämtlicher Farbstoffe,[56]
- ein aufgehelltes bis weißes Tier durch vollständigen oder teilweisen Ausfall von einem oder mehreren der folgenden Farbstoffe: Melanine, Pteridine, Carotine, Purine oder Ommatochrome (teilweiser oder vollständiger Albinismus).[10][68] Bei Säugetieren tritt diese Unklarheit nicht auf, da bei ihnen nur einer der infrage kommenden Farbstoffe zu Haut-, Haar- und Augenfarbe beiträgt, nämlich Melanin.
- Partieller Albinismus, Teilalbino: Immer noch falsch verwendet wird das Wort Albinismus in der Form „partieller Albinismus“ oder für das betroffene Tier „Teilalbino“ oft bei gescheckten Tieren. Bei dieser Erscheinung handelt es sich genetisch betrachtet um partiellen oder teilweisen Leuzismus.[56][81][82]
Literatur
- Aleksandra Lipka: Albinismus: Mutationssuche im TRP-1-Gen. Dissertation, Universität zu Lübeck 2004.
- P. M. Lund: Oculocutaneous albinism in southern Africa: Population structure, health and genetic care. In: Annals of Human Biology. Volume 32, Number 2, März/April 2005, S. 168–173.
- Barbara Käsmann-Kellner, Thorsten Schäfer, Christof M. Krick, Klaus W. Ruprecht, Wolfgang Reith, Bernd Ludwig Schmitz: Anatomische Unterschiede der Nervi optici, des Chiasmas und der Tractus optici bei normal- und hypopigmentierten Personen: eine standardisierte MRI- und fMRI-Untersuchung. In: Klinisches Monatsblatt Augenheilkunde. 220, 2003, S. 334–344.
- Charlotte Jaeger, Barrie Jay: X-linked ocular albinism. In: Human Genetics. Volume 56, Number 3, S. 299–304, Februar 1981.
- Birgit Lorenz, Markus Preising, Ulf Kretschmann: Molekulare und klinische Ophthalmogenetik. In: Deutsches Ärzteblatt. 98, Ausgabe 51-52 vom 24. Dezember 2001, S. A-3445, B-2902, C-2698
- TYRP1 tyrosinase-related protein 1 [ Homo sapiens ]. NCBI, GeneID: 7306, updated 07-Aug-2007, https://www.ncbi.nlm.nih.gov/sites/entrez?Db=gene&Cmd=ShowDetailView&TermToSearch=7306&ordinalpos=1&itool=EntrezSystem2.PEntrez.Gene.Gene_ResultsPanel.Gene_RVDocSum
- Markus Kaufmann: Albinismus: Das Tyrosinase-Gen in 78 Variationen. Inauguraldissertation. Universität zu Lübeck, 2004.
- Regine Witkowski, Otto Prokop, Eva Ullrich, G Thiel: Lexikon der Syndrome und Fehlbildungen: Ursachen, Genetik, Risiken. Springer, 2003, ISBN 3-540-44305-3, S. 86–88.
Weblinks
- NOAH Albinismus Selbsthilfegruppe e. V.
- Reportage: Jagd auf Albinos. Zeit Campus, April 2009.
- Esdras Ndikumana: Mörderbanden machen Jagd auf Albinos. Spiegel Online, 25. Oktober 2008.
Einzelnachweise
- Friedrich Kluge, Elmar Seebold: Etymologisches Wörterbuch der deutschen Sprache. Walter de Gruyter, 2002, ISBN 3-11-017473-1.
- D. B. van Dorp: Albinism, or the NOACH syndrome (the book of Enoch c.v. 1-20). In: Clinical genetics. Band 31, Nr. 4, April 1987, S. 228–242, PMID 3109790.
- Spanisch Piel de Luna bedeutet „Mondhaut“. Mexikanische Vereinigung für Albinos, siehe folgende Website, (spanisch; abgerufen am 8. Juli 2019)
- K. Grønskov, J. Ek, K. Brondum-Nielsen: Oculocutaneous albinism. Orphanet J Rare Dis. 2007 Nov 2;2:43. PMID 17980020, PMC 2211462 (freier Volltext)
- Albinism, Oculocutaneous, Type II; OCA2. In: Online Mendelian Inheritance in Man. (englisch).
- David L. Duffy, Grant W. Montgomery, Wei Chen, Zhen Zhen Zhao, Lien Le, Michael R. James, Nicholas K. Hayward, Nicholas G. Martin, Richard A. Sturm: A Three–Single-Nucleotide Polymorphism Haplotype in Intron 1 of OCA2 Explains Most Human Eye-Color Variation. In: Am J Hum Genet. 2007 Februar; 80(2), S. 241–252. PMID 18252222.
- S. N. Shekar, D. L. Duffy, T. Frudakis, R. A. Sturm, Z. Z. Zhao, G. W. Montgomery, N. G. Martin: Linkage and association analysis of spectrophotometrically quantified hair color in Australian adolescents: the effect of OCA2 and HERC2. In: Journal of Investigative Dermatology. 2008; Band 128(12), S. 2807–2814. PMID 18528436
- M. Soejima, H. Tachida, T. Ishida, A. Sano, Y. Koda: Evidence for recent positive selection at the human AIM1 locus in a European population. In: Mol Biol Evol. 2006 Jan;23(1), S. 179–188. Epub 2005 Sep 14. PMID 16162863.
- W. Haase: Amblyopie – Differentialdiagnose. In: Herbert Kaufmann u. a. (Hrsg.): Strabismus. Enke, Stuttgart 1986, ISBN 3-432-95391-7, S. 246.
- Tony Gamble, Jodi L. Aherns, Virginia Card: Tyrosinase Activity in the Skin of Three Strains of Albino Gecko (Eublepharis macularius). (PDF; 767 kB) In: Gekko. 5, S. 39–44.
- Shivendra Kishore and Stefan Stamm: The snoRNA HBII-52 Regulates Alternative Splicing of the Serotonin Receptor 2C. In: Science, 13. Januar 2006, Vol. 311, no. 5758, S. 230–232; doi:10.1126/science.1118265.
- B. Schüle, M. Albalwi, E. Northrop, D. I. Francis, M. Rowell, H. R. Slater, R. J. Gardner, U. Francke: Molecular breakpoint cloning and gene expression studies of a novel translocation t(4;15)(q27;q11.2) associated with Prader-Willi syndrome. In: BMC Med Genet. (2005) 6, S. 18.
- R. Saadeh, E. C. Lisi, D. A. Batista, I. McIntosh, J. E. Hoover-Fong: Albinism and developmental delay: the need to test for 15q11-q13 deletion. In: Pediatr Neurol. 2007 Oct;37(4), S. 299–302. PMID 17903679
- C. Fridman, N. Hosomi, M. C. Varela, A. H. Souza, K. Fukai, C. P. Koiffmann: Angelman syndrome associated with oculocutaneous albinism due to an intragenic deletion of the P gene. In: Am J Med Genet A. 2003 Jun 1;119A(2), S. 180–183, PMID 12749060.
- ANGELMAN SYNDROME; AS. In: Online Mendelian Inheritance in Man. (englisch).
- S. V. Dindot, B. A. Antalffy, M. B. Bhattacharjee, A. L. Beaudet: The Angelman syndrome ubiquitin ligase localizes to the synapse and nucleus, and maternal deficiency results in abnormal dendritic spine morphology. In: Hum Mol Genet., 1. Januar 2008, 17(1), S. 111–118. Epub 2007 Oct 16, PMID 17940072.
- Hermansky-Pudlak Syndrome; HPS. In: Online Mendelian Inheritance in Man. (englisch).
- HPS1 Hermansky-Pudlak syndrome 1 (Homo sapiens). NCBI Entrez Gene, GeneID: 3257.
- HPS2 Hermansky-Pudlak syndrome 2. In: Online Mendelian Inheritance in Man. (englisch).
- HPS3 Hermansky-Pudlak syndrome 3. In: Online Mendelian Inheritance in Man. (englisch).
- HPS4 Hermansky-Pudlak syndrome 4. In: Online Mendelian Inheritance in Man. (englisch).
- HPS5 Hermansky-Pudlak syndrome 5. In: Online Mendelian Inheritance in Man. (englisch).
- HPS6 Hermansky-Pudlak syndrome 6. In: Online Mendelian Inheritance in Man. (englisch).
- HPS7 Hermansky-Pudlak syndrome 7. In: Online Mendelian Inheritance in Man. (englisch).
- HPS8 Hermansky-Pudlak syndrome 8. In: Online Mendelian Inheritance in Man. (englisch).
- Griscelli Syndrome Type 1 (GS1). In: Online Mendelian Inheritance in Man. (englisch).
- Griscelli Syndrome Type 2 (GS2). In: Online Mendelian Inheritance in Man. (englisch).
- Griscelli Syndrome Type 3 (GS3). In: Online Mendelian Inheritance in Man. (englisch).
- Myosin VA; MYO5A. In: Online Mendelian Inheritance in Man. (englisch).
- RAS-Associated Protein RAB27A. In: Online Mendelian Inheritance in Man. (englisch).
- Melanophilin; MLPH. In: Online Mendelian Inheritance in Man. (englisch).
- P. Habermehl, S. Althoff, M. Knuf, J.-H. Höpner: Griscelli-Syndrom: ein Fallbericht. In: Klinische Pädiatrie, 215, 2003, S. 82–85.
- Noah S. Scheinfeld: Syndromic albinism: A review of genetics and phenotypes. In: Dermatology Online Journal, 9 (5), S. 5. PMID 14996378
- Lysosomal Trafficking Regulator; LYST. In: Online Mendelian Inheritance in Man. (englisch).
- Kakerlak. In: Heinrich August Pierer, Julius Löbe (Hrsg.): Universal-Lexikon der Gegenwart und Vergangenheit. 4. Auflage. Band 9: Johannes–Lackenbach. Altenburg 1860, S. 227 (Digitalisat. zeno.org).
- Fried. Ph. Blandin: Albinoismus. In: Universal-Lexicon der practischen Medicin und Chirurgie. Leipzig 1835, Band I, S. 251–253, hier S. 251: „Nach Aussage der Reisenden, werden sie [an Albinoismus erkrankte Menschen] […] auf Java Chacrelak genannt. Diese Benennung ist ein Ausdruck der Verachtung und bezeichnet eine Art von Schaben oder Milben, die sich gewöhnlich im Dunkeln aufzuhalten pflegen.“
- John Mason Good: Das Studium der Medizin. Leipzig 1840, Band IV, S. 577 [Art. Epichrosis Alphosis, Albinohaut, S. 576–581]: „Auf diese Weise ward in Folge der Unbehaglichkeit, welche sie durch das Licht erlitten, und ihre Gewohnheit, es zu vermeiden, denjenigen, welche man auf der Insel Java antraf, von den Holländern die verächtliche Venennung Kakerlaken, Insekten, welche im Dunkeln umherlaufen, beigelegt.“
- Irenäus Eibl-Eibesfeldt: Die Biologie des menschlichen Verhaltens. Piper, München / Zürich 1986, S. 409–417 (Mobbing: „Bewahrung der Gruppenidentität“).
- Martin Franke: Krank und diskriminiert. Unter der heißen Sonne Afrikas haben Menschen mit Albinismus ein schweres und kurzes Leben, in: F.A.S. Nr. 2, 14. Januar 2018, S. 20.
- Rico Czerwinski: Die Gejagten. In Tansania werden Albinos wie Tiere verfolgt und zu Medizin verarbeitet, in: Das Magazin, 12. September 2008. dasmagazin.ch (Memento vom 23. November 2010 im Internet Archive)
- Senegal: Albinos face perilous social rejection. In: IRIN News.
- Tansania: Fahndung nach vermisstem Albinokind. auf: ORF.at, 18. Januar 2015.
- Tansania: Keine Kindheit für Albinos arte.tv, ARTE Reportage, 2018, arte.de, 13. September 2018.
- Jeffrey Gettleman: Albinos, Long Shunned, Face Threat in Tanzania. In: The New York Times. 8. Juni 2008 (englisch, nytimes.com).
- J. Chung, J. Diaz: Africans With Albinism Hunted: Limbs Sold on Tanzania’s Black Market. 26. August 2010, abgerufen am 29. November 2010.
- Gewalt gegen Albinos in Malawi: „Welle von brutalen Übergriffen“. Spiegel Online, 7. Juni 2016.
- John Chiti NJ: Press Articles. AFZ Albinism Foundation of Zambia, abgerufen am 19. Juli 2020 (amerikanisches Englisch).
- Albinos hit by Zimbabwe’s race divide. auf: BBC News.
- Simbabwe kürt die hübscheste Albino-Schönheit
- Resolution der Generalversammlung, verabschiedet am 18. Dezember 2014. (PDF; 30,6 kB) 69/170. Internationaler Tag der Aufklärung über Albinismus. In: un.org. Vereinte Nationen (UN), 12. Februar 2015, abgerufen am 13. Juni 2020.
- Marcel Safier: Nineteenth Century Images of Albinism – Rudolph Lucasie and family (Memento vom 30. Oktober 2012 im Internet Archive)
- Krista Siebel: Analyse genetischer Varianten von Loci für die Fellfarbe und ihre Beziehungen zum Farbphänotyp und zu quantitativen Leistungsmerkmalen beim Schwein. Dissertation. Institut für Nutztierwissenschaften der Humboldt-Universität zu Berlin, Juli 2001, Kapitel 2 (Zusammenfassung des bisherigen Forschungsstandes).
- Petra Keller: Untersuchungen zur Entwicklung der frühen akustisch evozierten Potentiale (FAEP) bei der Katze für den Einsatz in der Grundlagenforschung und zur klinischen Anwendung. Dissertation. Tierärztliche Hochschule Hannover, 1997.
- Denis Mariat, Sead Taourit, Gérard Guérin: A mutation in the MATP gene causes the cream coat colour in the horse. In: Genetics Selection Evolution. 35, 2003 doi:10.1051/gse:2002039, S. 119–133.
- D. Cook, S. Brooks, R. Bellone, E. Bailey: Missense Mutation in Exon 2 of SLC36A1 Responsible for Champagne Dilution in Horses. In: PLoS Genet. 2008 Sep 19;4(9), S. e1000195. PMID 18802473.
- Hein van Grouw: Not every white bird is an albino: sense and nonsense about colour aberrations in birds. (PDF; 447 kB) In: Dutch Birding, vol. 28, no. 2, 2006, S. 79–89.
- H. Durrer, W. Villiger: Schillerradien des Goldkuckucks (Chrysococcyx cupreus (Shaw)) im Elektronenmikroskop. In: Cell and Tissue Research. Volume 109, Number 3 / September 1970.
- H. Durrer, W. Villiger: Schillerfarben der Trogoniden. In: Journal of Ornithology. Volume 107, Number 1 / Januar 1966, doi:10.1007/BF01671870.
- Matthew D. Shawkey, Geoffrey E. Hill: Significance of a basal melanin layer to production of non-iridescent structural plumage color: evidence from an amelanotic Steller’s jay (Cyanocitta stelleri). In: The Journal of Experimental Biology. 209, S. 1245–1250, doi:10.1242/jeb.02115.
- Jörg Odenthal, Karin Rossnagel, Pascal Haffter, Robert N. Kelsh, Elisabeth Vogelsang, Michael Brand, Fredericus J. M. van Eeden, Makoto Furutani-Seiki, Michael Granato, Matthias Hammerschmidt, Carl-Philipp Heisenberg, Yun-Jin Jiang, Donald A. Kane, Mary C. Mullins, Christiane Nüsslein-Volhard: Mutations affecting xanthophore pigmentation in the zebrafish, Danio rerio. In: Development. Vol 123, Issue 1, C 1996, S. 391–398.
- S. K. Frost-Mason, K. A. Mason: What insights into vertebrate pigmentation has the axolotl model system provided? In: Int J Dev Biol., 1996 Aug;40(4), S. 685–693. PMID 8877441.
- Albinism - Biology-Online Dictionary. Abgerufen am 29. Juni 2017 (englisch).
- Akihiko Koga, Hidehito Inagaki, Yoshitaka Bessho, Hiroshi Hori: Insertion of a novel transposable element in the tyrosinase gene is responsible for an albino mutation in the medaka fish, Oryzias latipes. In: Molecular and General Genetics MGG. Volume 249, Number 4 / July, 1995, S. 400–405, doi:10.1007/BF00287101, ISSN 0026-8925
- A. Koga, Y. Wakamatsu, J. Kurosawa, H. Hori: Oculocutaneous albinism in the i6 mutant of the medaka fish is associated with a deletion in the tyrosinase gene. In: Pigment Cell Res. 1999 Aug;12(4), S. 252–258. PMID 10454293
- A. Koga, H. Hori: Albinism due to transposable element insertion in fish. In: Pigment Cell Res. 1997 Dec;10(6), S. 377–381. PMID 9428004.
- A. Iida, H. Inagaki, M. Suzuki, Y. Wakamatsu, H. Hori, A. Koga: The tyrosinase gene of the i(b) albino mutant of the medaka fish carries a transposable element insertion in the promoter region. In: Pigment Cell Res. 2004 Apr;17(2), S. 158–164. PMID 15016305.
- M. E. Protas, C. Hersey, D. Kochanek, Y. Zhou, H. Wilkens, W. R. Jeffery, L. I. Zon, R. Borowsky, Clifford J. Tabin: Genetic analysis of cavefish reveals molecular convergence in the evolution of albinism. In: Nat Genet. 2006 Jan;38(1), S. 107–111. Epub 2005 Dec 11. PMID 16341223.
- S. K. Frost, L. G. Epp, S. J. Robinson: The pigmentary system of developing axolotls.
- Stephan C. F. Neuhauss, Oliver Biehlmaier, Mathias W. Seeliger, Tilak Das, Konrad Kohler, William A. Harris, Herwig Baier: Genetic Disorders of Vision Revealed by a Behavioral Screen of 400 Essential Loci in Zebrafish. In: The Journal of Neuroscience. October 1, 1999, 19(19), S. 8603–8615.
- Adam Amsterdam, Shawn Burgess, Gregory Golling, Wenbiao Chen, Zhaoxia Sun, Karen Townsend, Sarah Farrington, Maryann Haldi, Nancy Hopkins: A large-scale insertional mutagenesis screen in zebrafish. In: Genes & Development. 1999. 13, S. 2713–2724.
- M. Zhao, I. Söderhäll, J. W. Park, Y. G. Ma, T. Osaki, N. C. Ha, C. F. Wu, K. Söderhäll, B. L. Lee: A novel 43-kDa protein as a negative regulatory component of phenoloxidase-induced melanin synthesis. In: J Biol Chem. 2005 Jul 1;280(26), S. 24744–24751. Epub 2005 Apr 27. PMID 15857824
- K. Söderhäll, L. Cerenius: Role of the prophenoloxidase-activating system in invertebrate immunity. 1: In: Curr Opin Immunol. 1998 Feb;10(1), S. 23–28. PMID 9523106.
- R. D. Reed, L. M. Nagy: Evolutionary redeployment of a biosynthetic module: expression of eye pigment genes vermilion, cinnabar, and white in butterfly wing development. In: Evol Dev. 2005 Jul-Aug;7(4), S. 301–311. PMID 15982367.
- Alfred M. Handler, Anthony A. James: Insect Transgenesis: Methods and Applications. CRC-Press, 2000, ISBN 0-8493-2028-3, S. 81ff.
- S. M. Mackenzie, M. R. Brooker, T. R. Gill, G. B. Cox, A. J. Howells, G. D. Ewart: Mutations in the white gene of Drosophila melanogaster affecting ABC transporters that determine eye colouration. In: Biochim Biophys Acta. 1999 Jul 15;1419(2), S. 173–185. PMID 10407069.
- A. J. Howells: Isolation and biochemical analysis of a temperature-sensitive scarlet eye color mutant of Drosophila melanogaster. In: S. Biochem Genet. 1979 Feb;17(1-2), S. 149–158. PMID 110313.
- Vitus B. Dröscher: Weiße Löwen müssen sterben. Spielregeln der Macht im Tierreich. Rasch und Röhring, Hamburg 1989, S. 212–244 (Mobbing: „Tötet den Außenseiter!“).
- M. Protas, M. Conrad, J. B. Gross, C. Tabin, R. Borowsky: Regressive evolution in the Mexican cave tetra, Astyanax mexicanus. In: Current biology: CB. Band 17, Nummer 5, März 2007, S. 452–454, ISSN 0960-9822. doi:10.1016/j.cub.2007.01.051. PMID 17306543. PMC 2570642 (freier Volltext).
- R. Borowsky, H. Wilkens: Mapping a Cave Fish Genome: Polygenic Systems and Regressive Evolution. In: J Hered. 2002 Jan-Feb;93(1), S. 19–21. PMID 12011170.
- Gábor Horváth1, Miklós Blahó, György Kriska, Ramón Hegedüs, Balázs Gerics, Róbert Farkas, Susanne Åkesson: An unexpected advantage of whiteness in horses: the most horsefly-proof horse has a depolarizing white coat. In: Proc. R. Soc. B. 7. Juni 2010, vol. 277 no. 1688, S. 1643–1650, doi:10.1098/rspb.2009.2202.
- M. Tsudzuki, Y. Nakane, N. Wakasugi, M. Mizutani: Allelism of panda and dotted white plumage genes in Japanese quail. In: J Hered. 1993 May-Jun;84(3), S. 225–229. PMID 8228175.
- M. Miwa, M. Inoue-Murayama, H. Aoki, T. Kunisada, T. Hiragaki, M. Mizutani, S. Ito: Endothelin receptor B2 (EDNRB2) is associated with the panda plumage colour mutation in Japanese quail. In: Anim Genet., 2007 Apr;38(2), S. 103–108. Epub 2007 Feb 22. PMID 17313575.




