Adiponitril
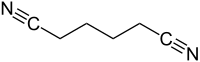
Adiponitril (ADN, Adipinsäuredinitril, Hexandisäuredinitril) gehört zu den aliphatischen Nitrilen und ist ein Zwischenprodukt der Polyamidherstellung.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Adiponitril | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H8N2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, fast geruchlose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 108,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
0,96 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
295 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser (50 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Brechungsindex |
1,4380 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Herstellung
Adiponitril wird hauptsächlich durch Hydrocyanierung von 1,3-Butadien hergestellt. Dabei wird Blausäure an die Doppelbindungen des Butadiens addiert. Verwendete Katalysatoren basieren auf Nickel oder Cobalt.[3]
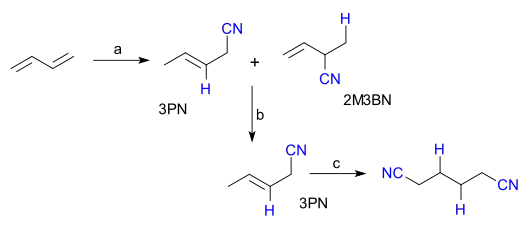
Zwei weitere Verfahren beruhen auf der Dimerisierung von Acrylnitril.
- Die elektrochemische Reduktion führt über eine Hydrodimerisierung direkt zu Adiponitril. Die Zelle für die Elektrosynthese enthält anodisch verdünnte Schwefelsäure und über ein Diaphragma abgetrennt kathodisch eine wässrige Lösung von Acrylnitril und Salze der 4-Toluolsulfonsäure als Lösungsvermittler für das wenig in Wasser lösliche Acrylnitril.[4]
- Die katalytische Dimerisierung ergibt ungesättigtes Hexendinitril, das zu Adiponitril hydriert wird.[5]
Im Labor kann es durch nucleophile Substitution von 1,4-Dichlorbutan mit NaCN in DMSO hergestellt werden.[6]
Kürzlich wurde über ein biotechnologisches Verfahren zur Herstellung von Adiponitril berichtet, bei dem auf die Verwendung giftiger Blausäure (oder von Cyaniden) verzichtet wird. Der Schlüsselschritt ist die zweifache Wasserabspaltung aus dem Hexandialdoxim, bei der Adiponitril gebildet wird. Dieser Schritt wird durch eine Aldoximdehydratase katalysiert.[7][8]
Verwendung
Adiponitril wird in großem Umfang zu Hexamethylendiamin hydriert.[9] Dieses ist ein Ausgangsstoff für die Herstellung von PA6.6. Die zweite Komponente, Adipinsäure, wird ausgehend von Cyclohexan hergestellt.[10]
Einzelnachweise
- Eintrag zu Adiponitril in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-10.
- Ji Yang, Peng Wang, Helfried Neumann, Ralf Jackstell, Matthias Beller: Industrially applied and relevant transformations of 1,3-butadiene using homogeneous catalysts. In: Industrial Chemistry & Materials. Band 1, Nr. 2, 2023, S. 155–174, doi:10.1039/D3IM00009E.
- Wolfgang-Dieter Luz, Eberhard Zirngiebl: Die Zukunft der Elektrochemie. In: Chemie in unserer Zeit. 23, 1989, S. 151–160, doi:10.1002/ciuz.19890230503
- J.R. Jennings, R.J. Cozens: Catalytic dimerisation of acrylonitrile. In: Applied Catalysis A: General. Band 124, Nr. 2, April 1995, S. 297–315, doi:10.1016/0926-860X(94)00260-6.
- Synthesis of adiponitrile - PrepChem.com. Abgerufen am 11. Juli 2018 (englisch).
- Harald Gröger: Biokatalyse – Lösungsansätze entlang der chemischen Wertschöpfungskette BIOspektrum 25 (2019), S. 786–789, doi: 10.1007/s12268-019-0093-3.
- T. Betke, M. Maier, H. Gruber-Wölfler, H. Gröger: Biocatalytic production of adiponitrile and related aliphatic linear α,ω-dinitriles, Nature Commun. 2018, 9, 5112, doi: 10.1038/s41467-018-0743-0.
- R Ramachandran: An overview of industrial uses of hydrogen. In: International Journal of Hydrogen Energy. Band 23, Nr. 7, Juli 1998, S. 593–598, doi:10.1016/S0360-3199(97)00112-2.
- Alex Tullo: Industry braces for nylon 6,6 shortage. In: C&EN Global Enterprise. Band 96, Nr. 40, 8. Oktober 2018, S. 22–23, doi:10.1021/cen-09640-feature3.
