Acridin
Acridin ist eine heteroaromatische organische Verbindung mit der Summenformel C13H9N. Acridin kommt im Steinkohlenteer vor, bildet farblose Kristalle und stellt das chemische Grundgerüst der Acridinfarbstoffe dar.[1]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
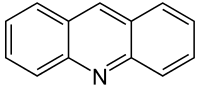 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Acridin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C13H9N | |||||||||||||||
| Kurzbeschreibung |
weißer bis fahlgelber Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 179,22 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,1 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
346 °C[2] | |||||||||||||||
| pKS-Wert |
5,58 (20 °C)[3] | |||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
Acridin wurde erstmals 1870 von Carl Graebe und Heinrich Caro aus Steinkohlenteer isoliert. Die Bezeichnung leitet sich von lateinisch acer (scharf) ab und ist auf die beißend hautreizende Wirkung von Acridin zurückzuführen.[6]
Gewinnung und Darstellung
Acridin kann aus Steinkohlenteer in der Anthracenfraktion gewonnen werden. Aus dieser kann es durch Ausschütteln mit verdünnter Schwefelsäure oder Natriumhydrogensulfit als Natriumacridinsulfonat extrahiert werden. Die freie Base wird durch Reaktion mit Natriumcarbonat freigesetzt.[4]
Es ist eine Reihe von Syntheseprozessen bekannt, die zu Acridin und dessen Derivaten führen. August Bernthsen kondensierte Diphenylamin mit Carbonsäuren in Gegenwart von Zinkchlorid. Dabei ergibt Ameisensäure Acridin, die höheren Homologen erzeugen Derivate mit den entsprechenden Alkylsubstituenten.[7]
Acridin kann auch gewonnen werden durch
- Durchleitung von Dampf des N-Phenyl-ortho-Toluidins durch ein rotglühendes Rohr[8]
- Kondensation von Diphenylamin mit Chloroform in Gegenwart von Aluminiumchlorid[9]
- Leitung von Dampf des ortho-Aminophenylphenylmethan über heißes Blei(II)-oxid[10]
- Erhitzen von Salicylaldehyd mit Anilin und Zinkchlorid auf 260 °C[11]
- Destillation von Acridon über Zinkstaub.[12]
- Reduktive Dehalogenierung von 9-Chloracridin[4]
Eigenschaften
Physikalische Eigenschaften
Acridin kristallisiert in farblosen Nadeln mit einem Schmelzpunkt bei 106–110 °C. Seine Salze zeigen in Lösung blaue Fluoreszenz.[1]
Chemische Eigenschaften
Acridin und seine Homologe sind sehr stabile Verbindungen mit schwach basischem Charakter. Durch Oxidation mit Kaliumpermanganat entsteht Acridinsäure (Chinolin-2,3-dicarbonsäure) C9H5N(COOH)2.[13]
Mit Alkyl- und Arylhalogeniden bildet Acridin leicht farbige Acridiniumsalze.[1]
Verwendung und Derivate
Acridin selbst besitzt praktisch keine industrielle Bedeutung. Die Synthese von Acridinfarbstoffen geht nicht von Acridin aus.[1][4]
Derivate des Acridins sind u. a. die Farbstoffe Acridinorange und Acridingelb, die Arzneimittel Acriflaviniumchlorid, Amsacrin und Ethacridinlactat sowie die Acridiniumester, die als Luminophore von Bedeutung sind.
Einzelnachweise
- Eintrag zu Acridin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- Datenblatt Acridin bei Merck, abgerufen am 20. März 2011.
- W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 5-88.
- G. Collin, H. Höke: Acridine, in: Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH Weinheim.
- W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-3.
- Carl Graebe, Heinrich Caro: Ueber Acridin. In: Berichte der deutschen chemischen Gesellschaft. Band 3, Nr. 2, Juli 1870, S. 746–747, doi:10.1002/cber.18700030223.
- A. Bernthsen: Acridine, in: Liebigs Ann. 1884, 224, 1–56; doi:10.1002/jlac.18842240102.
- C. Graebe: Ueber pyrogene Bildung des Acridins, in: Chem. Ber. 1884, 17, 1370–1371; doi:10.1002/cber.188401701353.
- O. Fischer, G. Körner: Neue Bildungsweise des Acridins, in: Chem. Ber. 1884, 17, 101–102; doi:10.1002/cber.18840170122.
- O. Fischer, H. Schütte: Ueber einige Synthesen der Acridinreihe und über 2,7-Phenylamidonaphtol, in: Chem. Ber. 1893, 26, 3085–3089; doi:10.1002/cber.189302603150.
- R. Möhlau: Bildungsweisen des Acridins, in: Chem. Ber. 1886, 19, 2451–2453; doi:10.1002/cber.188601902180.
- C. Graebe, K. Lagodzinski: Ueber Phenylantranilsäure und Acridon, in Chem. Ber. 1892, 25, 1733–1736; doi:10.1002/cber.189202501276.
- C. Graebe, H. Caro: Ueber Acridin, in: Chem. Ber 1880, 13, 99–103; doi:10.1002/cber.18800130128.
Siehe auch
- Anthracen, der stickstofffreie Stammkern
- Phenanthridin, das anguläre Isomer

