Acetylfluorid
Acetylfluorid ist eine chemische Verbindung aus der Gruppe der Acylhalogenide.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
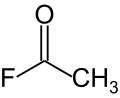 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Acetylfluorid | |||||||||||||||
| Andere Namen |
Ethanoylfluorid | |||||||||||||||
| Summenformel | C2H3FO | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 62,04 g·mol−1 | |||||||||||||||
| Dichte |
1,032 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
20,8 °C[1] | |||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Acetylfluorid kann durch Reaktion von Fluorwasserstoff und Essigsäureanhydrid gewonnen werden.[4]
Ebenfalls möglich ist die Darstellung durch Reaktion von Acetylchlorid mit Zinkfluorid[5] oder Kaliumfluorid in Eisessig oder Essigsäureanhydrid.[6]
Eigenschaften
Acetylfluorid greift Glas an.[7]
Literatur
- C. A. Bunton, J. H. Fendler: The Hydrolysis of Acetyl Fluoride. In: The Journal of Organic Chemistry. 31, 1966, S. 2307, doi:10.1021/jo01345a053
- Louis Pierce, Lawrence C. Krisher: Microwave Spectrum, Internal Barrier, Structure, Conformation, and Dipole Moment of Acetyl Fluoride. In: The Journal of Chemical Physics. 31, 1959, S. 875, doi:10.1063/1.1730542
- A. V. Kudich, V. A. Bataev, A. V. Abramenkov, I. A. Godunov: Quantum-chemical study of the structure of the acetyl fluoride molecule in the ground and lowest excited singlet and triplet electronic states. In: Spectrochim Acta A Mol Biomol Spectrosc. 60, 2004, S. 1995–2003, PMID 15248978.
Einzelnachweise
- David R. Lide: CRC Handbook of Chemistry and Physics A Ready-reference Book of Chemical and Physical Data. CRC Press, 1995, ISBN 978-0-8493-0595-5, S. 6 (eingeschränkte Vorschau in der Google-Buchsuche).
- SynQuest Labs, Inc.: Acetyl fluoride | SynQuest Labs, Inc., abgerufen am 26. März 2019
- W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-3.
- Matsuo Tanaka, Masahiro Fujiwara, Hisanori Ando: Dual Reactivity of the Formyl Cation as an Electrophile and a Broensted Acid in Superacids. In: The Journal of Organic Chemistry. 60, 1995, S. 3846, doi:10.1021/jo00117a041.
- Frank C. Whitmore: Organic Chemistry, Volume One Part I: Aliphatic Compounds Part II: Alicyclic Compounds. Courier Corporation, 2012, ISBN 978-0-486-60700-9, S. 291 (eingeschränkte Vorschau in der Google-Buchsuche).
- Houben-Weyl Methods of Organic Chemistry Vol. V/3, 4th Edition Fluorine and Chlorine Compounds. Georg Thieme Verlag, 2014, ISBN 3-13-179994-3, S. 148 (eingeschränkte Vorschau in der Google-Buchsuche).
- W.L.F. Armarego, Christina Chai: Purification of Laboratory Chemicals. Butterworth-Heinemann, 2013, ISBN 0-12-382161-4, S. 976 (eingeschränkte Vorschau in der Google-Buchsuche).
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.



