5,6-Dihydroxyindol-2-carbonsäure
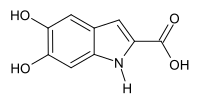
5,6-Dihydroxyindol-2-carbonsäure ist eine Chemische Verbindung und ein Derivat des Indols. Es ist ein Tautomer des Dopachroms. Im englischen Sprachraum findet man die Abkürzung DHICA, welche man ins Deutsche als DHICS (5,6-Dihydroxyindol-2-carbonsäure) übersetzen könnte.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | 5,6-Dihydroxyindol-2-carbonsäure | ||||||||||||
| Summenformel | C9H7NO4 | ||||||||||||
| Kurzbeschreibung |
lange, prismatische, fast weiße Kristalle[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 193,04 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt | |||||||||||||
| Löslichkeit |
| ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Gewinnung und Darstellung
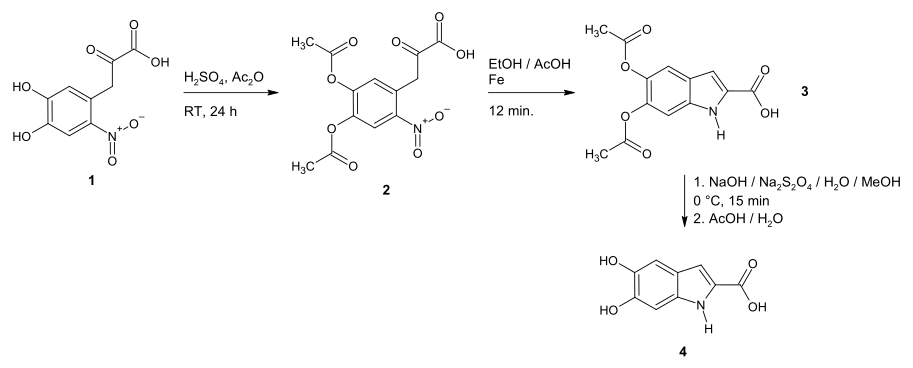
Beer et al. synthetisierte 5,6-Dihydroxyindol-2-carbonsäure 1949 aus der 3-(4,5-Dihydroxy-2-nitrophenyl)-2-oxopropansäure (1). Dazu waren drei Schritte nötig. Der erste Schritt war die Schützung der beiden phenolischen Hydroxygruppen mittels Acetanhydrid. Die Nitrogruppe des diacetylierten Zwischenprodukts 2 wurde dann mit Eisenpulver in ethanolischer Essigsäure reduziert, wobei gleichzeitig eine Kondensation des Ketons mit der dabei entstehenden Aminogruppe stattfand und so der 5-Ring entstand (Cyclisierung). Der letzte Schritt war die Entschützung der Hydroxygruppen, welche mit Natriumhydroxid und Natriumdithionit in wässrig/ethanolischer Lösung durchgeführt wurde. Die Reaktionslösung wurde dann noch mit Essigsäure neutralisiert, bevor das Produkt (4) isoliert wurde.[3][1]
Eigenschaften
Chemische Eigenschaften
- 5,6-Dihydroxyindol-2-carbonsäure kann nicht durch Sublimation gereinigt werden, weil es sich selbst im Hochvakuum bei Erwärmen in 6-Hydroxyindol[4] zersetzt.
- In eine alkoholische Lösung von Eisenchlorid gibt 5,6-Dihydroxyindol-2-carbonsäure eine starke blaue Farbe (erinnernd an Indigo).
- Mit Ehrlich’s Reagenz gibt es keine Farbreaktion.
- Wird ein Tropfen Natronlauge zu einer wässrig/ethanolischen Lösung von 5,6-Dihydroxyindol-2-carbonsäure und Natriumnitroprussid gegeben, färbt sich die Lösung erst orange; wird mit Essigsäure angesäuert verändert sich die Farbe zu grün-blau.
- In leicht alkalischer Lösung ist 5,6-Dihydroxyindol-2-carbonsäure recht stabil; im Gegensatz zu 5,6-Dihydroxyindol[5] findet keine schnelle, oxidative Polymerisation statt.[1]
Biologische Bedeutung
5,6-Dihyroxyindol-2-carbonsäure ist ein Zwischenprodukt in der Melanogenese. Man geht davon aus, dass die Farbe des im Organismus gebildeten Melanins vom Gleichgewicht zwischen der 5,6-Dihydroxyindol-2-carbonsäure und dem Dopachrom abhängt.[6]
Siehe auch
Einzelnachweise
- R. J. S. Beer, L. McGrath, A. Robertson, A. B. Woodier: 441. The chemistry of the melanins. Part II. The synthesis of 5: 6-dihydroxyindole-2-carboxylic acid and related compounds. In: Journal of the Chemical Society (Resumed). 1949, S. 2061–2066, doi:10.1039/JR9490002061.
- Datenblatt 5,6-Dihydroxyindol-2-carbonsäure (PDF) bei BLD Pharmatech, Katalognummer: BD236853, abgerufen am 20. Mai 2022.
- R. J. S. Beer, K. Clarke, H. G. Khorana, A. Robertson: 452. The chemistry of the melanins. Part I. The synthesis of 5: 6-dihydroxyindole and related compounds. In: Journal of the Chemical Society. 1948, S. 2223–2226, doi:10.1039/JR9480002223.
- Externe Identifikatoren von bzw. Datenbank-Links zu 6-Hydroxyindol: CAS-Nummer: 2380-86-1, EG-Nummer: 417-020-4, ECHA-InfoCard: 100.101.589, GESTIS-Stoffdatenbank: 901768, PubChem: 524508, ChemSpider: 457389, Wikidata: Q27257236.
- Externe Identifikatoren von bzw. Datenbank-Links zu 5,6-Dihydroxyindol: CAS-Nummer: 3131-52-0, EG-Nummer: 412-130-9, ECHA-InfoCard: 100.101.149, GESTIS-Stoffdatenbank: 901050, PubChem: 114683, ChemSpider: 102690, DrugBank: DB01811, Wikidata: Q9207472.
- J. M. Pawelek: After dopachrome? In: Pigment cell research. Band 4, Nr. 2, 1991, S. 53--62, doi:10.1111/j.1600-0749.1991.tb00315.x.
