4-Phenylphenol
4-Phenylphenol ist eine chemische Verbindung aus der Gruppe der Hydroxybiphenyle.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
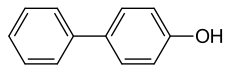 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 4-Phenylphenol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C12H10O | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff mit phenolartigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 170,21 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
321 °C[2] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
4-Phenylphenol kann durch Suzuki-Kupplung von Phenylboronsäure mit 4-Iodphenol in Gegenwart von 10 % Palladium auf Kohle und Kaliumcarbonat gewonnen werden.[4][5][6]
Eigenschaften
4-Phenylphenol ist ein brennbarer, schwer entzündbarer, weißer, schuppiger Feststoff mit phenolartigem Geruch, der sehr schwer löslich in Wasser ist.[1]
Verwendung
4-Phenylphenol wurde bei der Synthese eines neuen Polyphosphazen-Polyelektrolyts als Dispergiermittel von einwandigen Kohlenstoff-Nanoröhrchen in Wasser verwendet.[2] Es wird auch als Stabilisator für halogenierte Isopren/Isobutylen-Kautschuke eingesetzt.[7]
Einzelnachweise
- Eintrag zu 4-Phenylphenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- Datenblatt 4-Phenylphenol, 97% bei Sigma-Aldrich, abgerufen am 3. Juni 2017 (PDF).
- Michael Ash: Handbook of Preservatives. Synapse Info Resources, 2004, ISBN 978-1-890595-66-1, S. 489 (eingeschränkte Vorschau in der Google-Buchsuche).
- Brenton DeBoef: Praktikumsanleitung (Memento vom 17. September 2012 im Internet Archive)
- Hidehiro Sakurai, Tatsuya Tsukuda, Toshikazu Hirao: Pd/C as a Reusable Catalyst for the Coupling Reaction of Halophenols and Arylboronic Acids in Aqueous Media. In: The Journal of Organic Chemistry. 67, 2002, S. 2721, doi:10.1021/jo016342k.
- A. G. Kuznetsov, D. N. Korolev, N. A. Bumagin: Pd black in water as an efficient catalyst of the Suzuki reaction. In: Russian Chemical Bulletin. Band 52, Nr. 8, 2003, S. 1882–1883, doi:10.1023/A:1026097813946.
- Joachim Voigt: Die Stabilisierung der Kunststoffe gegen Licht und Wärme. Springer-Verlag, 2013, ISBN 978-3-642-52097-6, S. 488 (eingeschränkte Vorschau in der Google-Buchsuche).
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.

