4,5-Dihydroxy-2-nitrobenzaldehyd
4,5-Dihydroxy-2-nitrobenzaldehyd ist eine chemische Verbindung und ein einfaches Benzol-Derivat.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
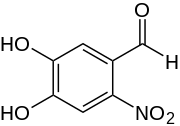 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | 4,5-Dihydroxy-2-nitrobenzaldehyd | ||||||||||||
| Summenformel | C7H5NO5 | ||||||||||||
| Kurzbeschreibung |
gelbes Pulver oder Kristalle[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 183,12 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Gewinnung und Darstellung
Die Synthese von 4,5-Dihydroxy-2-nitrobenzaldehyd aus Piperonal wurde 1985 von Bryan P. Murphy beschrieben. Das Piperonal wird zuerst bei −15 °C in 1,2-Dichlorethan mit rauchender Salpetersäure nitriert. Dann wird die Methylenbrücke im 5-Ring gebrochen. Dazu wird das Zwischenprodukt bei etwa 0 °C mit Aluminiumchlorid in 1,2-Dichlorethan behandelt und die Reaktionslösung dann in kalte, konzentrierte Bromwasserstoffsäure gegeben. Die so entstandene Lösung wird noch etwa 2 Tage ohne Temperaturkontrolle stehen gelassen. Nach Verdünnen mit Wasser kann das Produkt durch Extraktion mit Ethylacetat isoliert werden.[2]
Verwendung
4,5-Dihydroxy-2-nitrobenzaldehyd ist ein Zwischenprodukt in einigen Indol-Synthesen.[2][3]
Einzelnachweise
- Datenblatt 4,5-Dihydroxy-2-nitrobenzaldehyd (PDF) bei BLD Pharmatech, Katalognummer: BD297134, abgerufen am 21. Mai 2022.
- B. P. Murphy: Efficient synthesis of 5, 6-diacetoxyindole: a stable eumelanin precursor. In: The Journal of Organic Chemistry. Band 50, Nr. 26, 1985, S. 5873–5875, doi:10.1021/jo00350a089.
- R. J. S. Beer, K. Clarke, H. G. Khorana, A. Robertson: 452. The chemistry of the melanins. Part I. The synthesis of 5: 6-dihydroxyindole and related compounds. In: Journal of the Chemical Society. 1948, S. 2223–2226, doi:10.1039/JR9480002223.
