3,5-Diethyl-1,2,4-trithiolan
3,5-Diethyl-1,2,4-trithiolan ist eine chemische Verbindung aus der Gruppe der Trithiolane, also der Heterocyclen mit einem Fünfring, der zwei Kohlenstoff- und drei Schwefelatome enthält.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
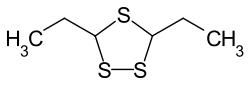 | |||||||||||||
| Struktur ohne cis-/trans-Isomerie | |||||||||||||
| Allgemeines | |||||||||||||
| Name | 3,5-Diethyl-1,2,4-trithiolan | ||||||||||||
| Summenformel | C6H12S3 | ||||||||||||
| Kurzbeschreibung |
gelbe Flüssigkeit[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 180,35 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||
| Dichte |
1,147–1,160 g·cm−3[1] | ||||||||||||
| Siedepunkt | |||||||||||||
| Löslichkeit | |||||||||||||
| Brechungsindex |
1,558–1,570[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||
Isomere
Es existieren ein cis- und ein trans-Isomer, die sich durch die relative Stellung der Ethylgruppen unterscheiden. Die Isomere sind durch Chromatographie trennbar und können unter geeigneten Bedingungen mittels NMR-Spektroskopie unterschieden werden.[3]
Vorkommen

3,5-Diethyl-1,2,4-trithiolan kommt natürlich in Knoblauch, Zwiebeln und Schnittlauch vor.[4][5][6][7] Im Schnittlauch kommen bei Stereoisomere vor.[8]
Gewinnung und Darstellung
3,5-Diethyl-1,2,4-trithiolan kann durch Oxidation von 2,4,6-Triethyl-1,3,5-dithiazinan gewonnen werden. Letzteres kann wiederum durch Reaktion einer Ammoniumsulfidlösung in Tetrahydrofuran mit Propanal und Methyl-tert-butylether gewonnen werden.[9] Die Verbindung kann auch durch Maillard-Reaktionen gebildet wurden, so war das trans-Isomer eines der Hauptprodukte bei einer Modellreaktion unter Zersetzung von Ascorbinsäure in Gegenwart von Cystein.[10]
Eigenschaften
3,5-Diethyl-1,2,4-trithiolan ist eine gelbe Flüssigkeit, die praktisch unlöslich in Wasser ist.[1]
Verwendung
3,5-Diethyl-1,2,4-trithiolan wird als Aromastoff verwendet.[5] Mit einer Reinheit von mindestens 95 % ist es in der EU unter der FL-Nummer 15.049 als Aromastoff für Lebensmittel allgemein zugelassen.[11]
Einzelnachweise
- FAO: Food safety and quality: details, abgerufen am 11. Januar 2021.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- S.B. Tjan, J.C. Haakman, C.J. Teunis, H.G. Peer: Synthesis of 3,5-dialkyl-1,2,4-trithiolanes. In: Tetrahedron. Band 28, Nr. 13, Januar 1972, S. 3489–3500, doi:10.1016/0040-4020(72)88110-9.
- T. K. Lim: Edible Medicinal and Non Medicinal Plants Volume 9, Modified Stems, Roots, Bulbs. Springer, 2014, ISBN 978-94-017-9511-1, S. 146 (eingeschränkte Vorschau in der Google-Buchsuche).
- George A. Burdock: Fenaroli's Handbook of Flavor Ingredients. CRC Press, 2016, ISBN 978-1-4200-9086-4, S. 421 (eingeschränkte Vorschau in der Google-Buchsuche).
- SEIJI HASHIMOTO, MITSUO MIYAZAWA, HIROMU KAMEOKA: Volatile Flavor Components of Chive (Allium schoenoprasum L.). In: Journal of Food Science. 48, 1983, S. 1858, doi:10.1111/j.1365-2621.1983.tb05101.x.
- Tung Hsi Yu, Chung May Wu, Yoh Cherng Liou: Volatile compounds from garlic. In: Journal of Agricultural and Food Chemistry. Band 37, Nr. 3, Mai 1989, S. 725–730, doi:10.1021/jf00087a032.
- Seiji Hashimoto, Mitsuo Miyazawa, Hiromu Kameoka: Volatile Flavor Components of Chive (Allium schoenoprasum L.). In: Journal of Food Science. Band 48, Nr. 6, November 1983, S. 1858–1859, doi:10.1111/j.1365-2621.1983.tb05101.x.
- Patent EP1797066B1: Disubstituierte Tetrathiane als Duft- oder Aromastoffe. Angemeldet am 6. September 2005, veröffentlicht am 12. November 2014, Anmelder: Symrise AG, Erfinder: Frank Ott et al.
- Ai-Nong Yu, Zhi-Wei Tan, Fa-Song Wang: Mechanism of formation of sulphur aroma compounds from l-ascorbic acid and l-cysteine during the Maillard reaction. In: Food Chemistry. Band 132, Nr. 3, Juni 2012, S. 1316–1323, doi:10.1016/j.foodchem.2011.11.111.
- Food and Feed Information Portal Database | FIP. Abgerufen am 25. August 2023.